

分析 (1)該裝置是原電池,反應原理為二氧化硫、氧氣和水反應生成硫酸,負極上的物質失電子發生氧化反應,正極上的物質得電子發生還原反應,據此分析M極發生的電極反應式;
(2)根據Q=It和N=$\frac{Q}{e}$結合SO2-2e-+2H2O=4H++SO42-計算;
(3)SO2被Na2SO3溶液吸收生成亞硫酸氫鈉,硫酸氫鈉是強電解質完全電離;
(4)①NaHSO3溶液中主要以HSO3-存在,HSO3-的電離很微弱,所以n(SO32-):n(HSO3-)<1:1,根據圖象知,當亞硫酸氫根離子的物質的量大于亞硫酸根離子的物質的量時,亞硫酸氫鈉溶液呈酸性,亞硫酸氫根離子既能水解又能電離,亞硫酸氫鈉溶液呈酸性同時說明HSO3-的電離程度大于水解程度,隨$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的減小,PH逐漸減小,PH減小,當$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已顯酸性,當為NaHSO3溶液,溶液PH一定小于6.2;
②$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的=1:1,溶液為NaHSO3溶液和Na2SO3溶液,溶液PH=7.2,溶液略顯堿性,說明HSO3-的電離程度小于水解程度;
(5)①陽極上陰離子放電發生氧化反應;
②陰極上為陽離子H+得電子生成氫氣.
解答 解:(1)該裝置是原電池,反應原理為二氧化硫、氧氣和水反應生成硫酸,通入氧氣的N電極是正極,原電池放電時,氫離子由負極移向正極,正極上氧氣得電子和氫離子反應生成水,電極反應式為:O2+4e-+4H+=2H2O,負極M上,二氧化硫失電子和水反應生成硫酸,電極反應式為:SO2-2e-+2H2O=4H++SO42-,
故答案為:SO2-2e-+2H2O=4H++SO42-;
(2)根據Q=It=2A×60s=120C,N=$\frac{Q}{e}$=$\frac{120}{1.6×1{0}^{-19}}$=7.5×1020個,
由SO2~~~~2e-
22.4 2×6.02×1023
V 7.5×1020
V=$\frac{22.4×7.5×1{0}^{20}}{2×6.02×1{0}^{23}}$≈0.014L,
故答案為:0.014;
(3)SO2被Na2SO3溶液吸收生成亞硫酸氫鈉,離子反應為SO32-+SO2+H2O=2HSO3-,
故答案為:SO32-+SO2+H2O=2HSO3-;
(4)①圖象分析可知,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:1,溶液PH=7.2,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$<1:1,PH<7,溶液顯酸性,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液顯酸性,所以當為NaHSO3溶液,NaHSO3溶液中HSO3-存在電離平衡,HSO3-?H++SO32- 和水解平衡:HSO3-+H2O?H2SO3+OH-,HSO3-的電離程度大于水解程度,溶液顯酸性,隨$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的減小,PH逐漸減小,PH減小,當$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已顯酸性,當為NaHSO3溶液,溶液PH一定小于6.2,溶液顯酸性,
故答案為:隨$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的減小,PH逐漸減小,PH減小,當$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已顯酸性,當為NaHSO3溶液,溶液PH一定小于6.2,溶液顯酸性;
②$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:1,溶液為NaHSO3溶液和Na2SO3溶液,溶液PH=7.2,溶液略顯堿性,說明HSO3-的電離程度小于水解程度,溶液中離子濃度大小為:c(Na+)>c(SO32-)=c(HSO3-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(SO32-)=c(HSO3-)>c(OH-)>c(H+);
(5)①當吸收液的pH降至約為6時,吸收液中陰離子主要是亞硫酸氫根離子,亞硫酸氫根離子在陽極上失電子和水反應生成硫酸根離子和氫離子,電極反應式為:HSO3-+H2O-2e-=SO42-+3H+,
故答案為:HSO3-+H2O-2e-=SO42-+3H+;
②陰極上為陽離子H+得電子生成氫氣,其電極反應式為:2H++2e-=H2↑,所以當電極上有2mol電子轉移時,生成1mol氫氣,即陰極產物的質量為2g,
故答案為:2g.
點評 本題綜合性較大,涉及到離子方程式、電解原理和離子濃度大小的比較、化學平衡影響因素以及電化學知識等知識點,為高考常見題型,側重于學生的分析能力的考查,難度較大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:推斷題
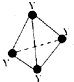 已知X的電負性在同主族元素中最大,其基態原子最外電子層的p軌道呈半充滿狀態.回答下列問題:
已知X的電負性在同主族元素中最大,其基態原子最外電子層的p軌道呈半充滿狀態.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
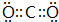 ,B與D形成的原子個數比為l:l的化合物中含有的化學鍵類型有離子鍵和共價鍵.
,B與D形成的原子個數比為l:l的化合物中含有的化學鍵類型有離子鍵和共價鍵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:Na2CO3<NaHCO3 | |
| B. | 相同溫度下在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 取1 mol•L-1的兩種溶液,分別滴加澄清石灰水,有沉淀生成的是Na2CO3溶液 | |
| D. | 取等質量的兩種固體分別與等濃度等體積的鹽酸反應,生成氣泡較快的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X與Y形成的化合物中,X可以顯負價,Y顯正價 | |
| B. | 最高價含氧酸的酸性:X對應的酸性強于Y對應的酸性 | |
| C. | 第一電離能X一定大于Y | |
| D. | 氣態氫化物的穩定性:HmY小于HnX |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
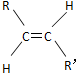 和
和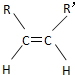 兩種空間形式(同分異構體),判斷下列化合物中具有上述兩種空間排列形式的是( )
兩種空間形式(同分異構體),判斷下列化合物中具有上述兩種空間排列形式的是( )| A. | 乙烯 | B. | 2-戊烯 | C. | 苯乙烯 | D. | 乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素X形成的單質一定是原子晶體 | |
| B. | X與Z形成的化合物具有熔點高、硬度大的特點 | |
| C. | Y與氧元素形成的化合物Y2O2中陰、陽離子的個數比為1:1 | |
| D. | W分別與Y、Z形成的化合物中含有的化學鍵類型相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com