
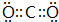 ,B與D形成的原子個數比為l:l的化合物中含有的化學鍵類型有離子鍵和共價鍵.
,B與D形成的原子個數比為l:l的化合物中含有的化學鍵類型有離子鍵和共價鍵.分析 A、B、C、D都是短周期元素,原子半徑D>C>A>B,其中A、B處在同一周期,A、C處在同一主族,四種元素在周期表中的大致相對位置為: ,A、C處在同一主族,二者質子數相差8,C原子核內質子數等于A、B原子核內質子數之和,故B的質子數為8,B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,故C最外層電子數為4,D的最外層電子數為1,故A為C元素,B為O元素,C為Si元素,D為Na元素,據此解答該題.
,A、C處在同一主族,二者質子數相差8,C原子核內質子數等于A、B原子核內質子數之和,故B的質子數為8,B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,故C最外層電子數為4,D的最外層電子數為1,故A為C元素,B為O元素,C為Si元素,D為Na元素,據此解答該題.
解答 解:A、B、C、D都是短周期元素,原子半徑D>C>A>B,其中A、B處在同一周期,A、C處在同一主族,四種元素在周期表中的大致相對位置為: ,A、C處在同一主族,二者質子數相差8,C原子核內質子數等于A、B原子核內質子數之和,故B的質子數為8,B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,故C最外層電子數為4,D的最外層電子數為1,故A為C元素,B為O元素,C為Si元素,D為Na元素,
,A、C處在同一主族,二者質子數相差8,C原子核內質子數等于A、B原子核內質子數之和,故B的質子數為8,B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,故C最外層電子數為4,D的最外層電子數為1,故A為C元素,B為O元素,C為Si元素,D為Na元素,
(1)由上面的分析可知,A為C元素,B為O元素,C為Si元素,D為Na元素,故答案為:碳、氧、硅、鈉;
(2)四種元素中在常溫常壓下有液態或氣態氫化物的為C、O、Si,它們的非金屬性O>C>Si,故氫化物的穩定性為H2O>CH4>SiH4,
故答案為:H2O>CH4>SiH4;
(3)A與B形成的三原子分子為CO2,其電子式是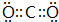 ,B與D形成的原子個數比為1:1的化合物為過氧化鈉,它的電子式是
,B與D形成的原子個數比為1:1的化合物為過氧化鈉,它的電子式是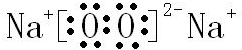 ,由電子式可知Na2O2含有離子鍵和共價鍵,故答案為:
,由電子式可知Na2O2含有離子鍵和共價鍵,故答案為: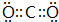 ;離子鍵和共價鍵;
;離子鍵和共價鍵;
(4)利用非金屬與氫氣化合的難易程度、氣態氫化物的穩定性、最高價氧化物的水化物的酸性、非金屬單質之間的置換反應等來判斷非金屬性的強弱,如可以利用碳酸的酸性強于硅酸證明:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,故答案為:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
點評 本題考查元素位置結構性質的關系,關鍵是正確推斷元素的種類,強化金屬性、非金屬性強弱的判斷依據,學會書寫電子式并能分析化學鍵的類型,考點比較全面,基礎性強,有利于學生復習回顧物質結構的相關知識,難度中等.


 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:解答題
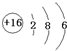 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應熱的大小與反應物所具有的能量和生成物所具有的能量無關 | |
| B. | 已知C(石墨,s)═C(金剛石,s)△H>0,則金剛石比石墨穩定 | |
| C. | 已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ•mol-1,則任何酸堿中和的反應熱均為57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2 CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2;則△H1<△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

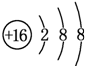 ;D與E能形成一種結構類似于CO2的三原子分子,且每個原子均達到了8e-穩定結構,該分子的電子式為
;D與E能形成一種結構類似于CO2的三原子分子,且每個原子均達到了8e-穩定結構,該分子的電子式為 ,化學鍵類型為極性共價鍵(填“離子鍵”、“非極性共價鍵”或“極性共價鍵”).
,化學鍵類型為極性共價鍵(填“離子鍵”、“非極性共價鍵”或“極性共價鍵”).查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com