
分析 (1)氫氧化鉀摩爾質量比氫氧化鈉大,b g氫氧化鉀物質的量比b g氫氧化鈉物質的量小,酸未完全反應;
(2)氫氧化鋇摩爾質量比氫氧化鈉遠大(超過2倍),b g氫氧化鋇物質的量不到b g氫氧化鈉物質的量的一半,OH- 少于b g氫氧化鈉中OH-物質的量,酸未完全反應;
(3)氫氧化鉀與氫氧化鈉都是一元強堿,所以a mol氫氧化鉀,與a mol的氫氧化鈉,中和能力相同;
(4)氫氧化鈣是二元強堿,如果改用a mol氫氧化鈣提供氫氧根離子的量是a mol氫氧化鈉的2倍;
(5)b g的氫氧化鈉提供氫氧根離子的能力是amol,則a=$\frac{b}{40}$;而b g氫氧化鈣提供氫氧根離子的能力是$\frac{b}{74}×2$mol>a;
(6)如果改用2a mol氫氧化鋇,提供4a mol的氫氧根離子;溶液呈中性只需amol的氫氧根離子,①如果氫氧根離子大于氫離子,溶液呈堿性;②如果氫氧根離子等于氫離子,溶液呈中性;③如果氫氧根離子小于氫離子,溶液呈酸性,由此分析解答.
解答 解:(1)氫氧化鉀摩爾質量比氫氧化鈉大,b g氫氧化鉀物質的量比b g氫氧化鈉物質的量小,酸未完全反應,溶液呈酸性;
(2)如果改用b g氫氧化鋇,氫氧化鋇摩爾質量比氫氧化鈉遠大(超過2倍),b g氫氧化鋇物質的量不到b g氫氧化鈉物質的量的一半,OH- 少于b g氫氧化鈉中OH-物質的量,酸未完全反應,反應后的溶液呈酸性;
(3)如果改用a mol氫氧化鉀,氫氧化鉀與氫氧化鈉都是一元強堿,所以a mol氫氧化鉀,與a mol的氫氧化鈉,中和能力相同,反應后的溶液呈中性;
(4)如果改用a mol氫氧化鈣,氫氧化鈣是二元強堿,如果改用a mol氫氧化鈣提供氫氧根離子的量是a mol氫氧化鈉的2倍,酸不足,反應后的溶液呈堿性;
(5)如果改用b g氫氧化鈣,b g的氫氧化鈉提供氫氧根離子的能力是amol,則a=$\frac{b}{40}$;而b g氫氧化鈣提供氫氧根離子的能力是$\frac{b}{74}×2$mol>a,堿過量,所以反應后的溶液呈堿性;
(6)如果改用2a mol氫氧化鋇,提供4a mol的氫氧根離子;溶液呈中性只需amol的氫氧根離子,堿過量,所以反應后的溶液呈堿性;
故答案為:(1)酸;(2)酸;(3)中;(4)堿;(5)堿;(6)堿.
點評 本題考查酸堿中和反應后的溶液酸堿性,強堿提供氫氧根離子的濃度與強酸提供氫離子的相對大小,如果濃度相等反應后溶液呈中性,比較容易.


科目:高中化學 來源: 題型:解答題
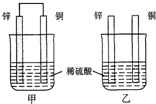 現有如下兩個反應:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑
現有如下兩個反應:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 與葡萄糖互為同分異構體 | |
| B. | 既可以與氧氣反應,也可以與新制氫氧化銅反應 | |
| C. | 1個核糖分子可以與4個乙酸分子發生取代反應 | |
| D. | 不能使紫色石蕊試液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 44g | B. | 0.335mol | C. | 29.48g | D. | 0.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 結論 |
| A. | 將稀硝酸加入過量鐵粉中,充分反應后滴加KSCN溶液 | 有氣體生成,溶液呈血紅色 | 稀硝酸將Fe氧化為Fe3+ |
| B. | 將水蒸氣通過灼熱的鐵粉 | 粉末變紅 | 鐵與水在高溫下發生反應 |
| C. | AgI沉淀中滴加稀KCl溶液 | 有白色沉淀出現 | AgCl的溶度積比AgI的小 |
| D. | 去少量無色溶液,先滴加氯水,再加入少量CCl4,振蕩,靜置 | 溶液分層,下層呈橙紅色 | 原無色溶液中含有溴離子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用托盤天平稱量藥品時,將藥品置于天平右盤 | |
| B. | 蒸餾實驗中,要在燒瓶中加入沸石或碎瓷片,以防止液體暴沸 | |
| C. | 用托盤天平稱取10.50g干燥的NaCl固體 | |
| D. | 向沸騰的NaOH稀溶液中滴加FeCl3飽和溶液,以制備Fe(OH)3膠體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com