
 (1)可逆反應N2(g)+3H2(g)2NH3(g)是一個放熱反應,有甲乙兩個完全相同的容器,向甲容器中加入1molN2和3molH2在一定條件下,達到平衡時放出的熱量為Q1,相同條件下,向乙容器中加入2molNH3,達到平衡時,吸收的熱量為Q2,已知Q2=4Q1,則甲容器中H2的轉化率為
(1)可逆反應N2(g)+3H2(g)2NH3(g)是一個放熱反應,有甲乙兩個完全相同的容器,向甲容器中加入1molN2和3molH2在一定條件下,達到平衡時放出的熱量為Q1,相同條件下,向乙容器中加入2molNH3,達到平衡時,吸收的熱量為Q2,已知Q2=4Q1,則甲容器中H2的轉化率為| △c |
| △t |
| 2-2x |
| 2 |
| 0.2mol×3 |
| 3mol |


科目:高中化學 來源: 題型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
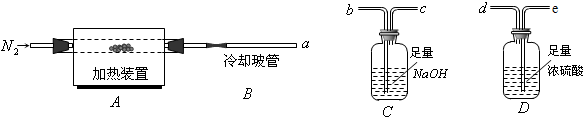
 如圖是實驗室制取某些氣體的裝置.
如圖是實驗室制取某些氣體的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
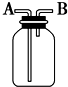
| A、瓶中盛有適量濃H2SO4,從A口進氣來干燥NH3 |
| B、從B口進氣,用排空氣法收集CO2 |
| C、瓶中盛滿水,從B口進氣,用排水法收集NO2 |
| D、瓶中裝滿水,A口連接導管并伸入量筒中,從B口進氣,用排水法測量生成H2的體積 |
查看答案和解析>>
科目:高中化學 來源: 題型:
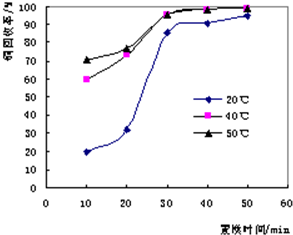
| A、實驗裝置保溫、隔熱效果差 |
| B、量取NaOH溶液的體積時仰視讀數 |
| C、分多次把NaOH溶液倒入盛有硫酸的小燒杯中 |
| D、用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com