
分析 無色氣體中一定不含有紅棕色的NO2;
通過盛有濃硫酸的洗氣瓶,發現氣體減少一部分體積,說明一定含有與濃硫酸反應的NH3;
繼續通過裝有Na2O2固體的干燥管,發現從干燥管出來的氣體顏色呈紅棕色,說明含有CO2和NO,CO2和過氧化鈉反應生成氧氣,氧氣和NO反應生成紅棕色氣體NO2;
繼續將氣體通入盛滿水倒立于水槽中的試管內,最后氣體完全被吸收,試管內仍然充滿液體,說明不含不溶于水的N2、H2,以此解答該題.
解答 解:混合氣體為無色,則一定不含紅棕色的氣體NO2;通過盛有濃硫酸的洗氣瓶,發現氣體體積減少一部分,說明混合氣體中含有與濃硫酸發生反應的氣體NH3;
繼續通過裝有Na2O2固體的干燥管,發現從干燥管出來的氣體顏色呈紅棕色,該紅棕色氣體為二氧化氮,說明原混合氣體中含有CO2和NO,CO2和過氧化鈉反應生成氧氣,氧氣和NO反應生成紅棕色氣體NO2;再繼續將氣體通入盛滿水倒立于水槽中的試管內,最后氣體完全被吸收,試管內充滿液體,說明原混合氣體中不含不溶于水的N2、H2,
由以上分析可知,混合氣體中一定含有的氣體為:NH3、CO2、NO,一定不含有的氣體為:N2、NO2、H2,
故答案為:CO2、NH3、NO;HCl、NO2、H2.
點評 本題考查物質的檢驗和鑒別的實驗設計,題目難度中等,注意掌握常見氣體的性質及檢驗方法,試題側重于學生的分析能力和計算能力的考查,為高頻考點,注意相關基礎知識的積累.


科目:高中化學 來源: 題型:選擇題
| A. | 溴乙烷在濃硫酸加熱條件下可制得乙烯 | |
| B. | 一定條件下,所有的醇均能發生脫水反應形式碳碳雙鍵或碳碳叁鍵 | |
| C. | 石油的裂化、裂解,煤的氣化、液化都是化學變化 | |
| D. | 在酸性條件下,CH3CO18OC2H5的水解產物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
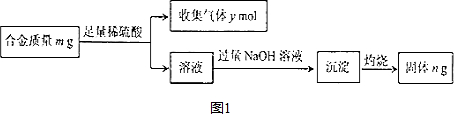
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
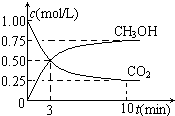 隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視.
隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅與稀硫酸反應時加入少量硫酸銅,反應加快的主要原因是Cu2+水解增大了H+濃度 | |
| B. | 鉛蓄電池放電時的負極和充電時的陰極均發生氧化反應 | |
| C. | 電解法精煉銅時,以粗銅作陰極,純銅作陽極 | |
| D. | 鍍鋅鐵鍍層破損后鋅仍能減緩鐵腐蝕,其原理為犧牲陽極的陰極保護法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟、預期現象 | 結論 |
| ①向溶液中加入四氯化碳,操作振蕩、靜置, 現象CCl4層呈橙紅色,水層呈無色 | 假設1正確 |
| ②向溶液中另入KSCN溶液, 現象溶液變為紅色 | 假設2正確 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
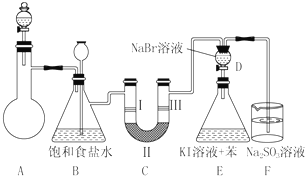
| 編號 | a | b | c | d |
| Ⅰ | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com