

 (1)FeCl3具有凈水作用,但腐蝕設備,FeCl3溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有凈水作用,但腐蝕設備,FeCl3溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示)2Fe3++Fe=3Fe2+.
分析 (1)鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子;
(2)氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據得失電子守恒,則氯酸根離子的系數為1,Fe2+的系數為6,則鐵離子的系數也是6,氯離子的系數是1,根據電荷守恒,則氫離子的系數是6,水的系數是3;
(3)足量Cl2通入和KOH溶液中,溫度低時發生反應Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯氣完全反應,且將溶液轉化為堿性溶液,只有堿性條件下次氯酸根離子才能和鐵離子發生氧化還原反應生成高鐵酸根離子,除去KCl得到堿性的KClO濃溶液,向堿性的KClO濃溶液中加入90%的Fe(NO3)3溶液,發生反應2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,純化得到濕產品,將濕產品洗滌、干燥得到晶體K2FeO4.
①根據過濾的操作步驟分析所用儀器,玻璃儀器有漏斗、燒杯和玻璃棒;
②KOH和氯氣反應生成KClO,除去未反應的氯氣,且只有堿性條件下,鐵離子才能和次氯酸根離子發生氧化還原反應生成高鐵酸根離子;
③Fe3+水解生成的Fe(OH)3膠體粒子能吸附水中的懸浮雜質,可起到凈水的作用;
(4)電解時陽極Fe失電子發生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
(5)裝置為原電池,若用d裝置保護鐵,X極的電極材料應比鐵活潑.
解答 解:(1)鐵離子具有氧化性,鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子,離子方程式是:2Fe3++Fe=3Fe2+,故答案為:2Fe3++Fe=3Fe2+;
(2)氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據得失電子守恒,則氯酸根離子的系數為1,Fe2+的系數為6,則鐵離子的系數也是6,氯離子的系數是1,根據電荷守恒,則氫離子的系數是6,水的系數是3,配平后離子方程式為:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案為:1;6;6H+;1;6;3H2O;
(3)①過濾,玻璃儀器有漏斗作過濾器,燒杯盛放待過濾液、和過濾液,玻璃棒作用為引流,
故答案為:漏斗、燒杯、玻璃棒;
②KOH和氯氣反應生成KClO,除去未反應的氯氣,且只有堿性條件下,鐵離子才能和次氯酸根離子發生氧化還原反應生成高鐵酸根離子,所以加入KOH的目的是除去氯氣且使溶液為后一步反應提供堿性,
故答案為:為下一步反應提供反應物;
③鐵酸鈉被還原后的產物Fe3+水解生成的Fe(OH)3膠體粒子能吸附水中的懸浮雜質,可起到凈水的作用,Fe3+水解離子方程式為:Fe3++3H2O?Fe(OH)3(膠體)+3H+,
故答案為:Fe3++3H2O?Fe(OH)3(膠體)+3H+;
(4)電解時陽極Fe失電子發生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O,故答案為:Fe+8OH--6e-═FeO42-+4H2O;
(5)裝置為原電池,若用d裝置保護鐵,X極的電極材料應比鐵活潑可以選擇鋅,故答案為:A.
點評 本題考查了氧化還原反應、原電池和電解池原理、物質的分離與提純等,題目難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力,注意基礎知識的掌握.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
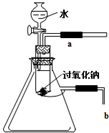 用脫脂棉包住0.2g過氧化鈉粉末,置于石棉網上,往脫脂棉上滴幾滴水,可觀察到脫脂棉劇烈燃燒起來.
用脫脂棉包住0.2g過氧化鈉粉末,置于石棉網上,往脫脂棉上滴幾滴水,可觀察到脫脂棉劇烈燃燒起來.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應 | 大氣固氮 N2(g)+O2(g)?2NO(g) | 工業固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硅溶于水顯酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色膠狀物質 | |
| C. | 因為高溫時,二氧化硅與碳酸鈉反應放出二氧化碳,所以硅酸的酸性比碳酸強 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 學習化學應該明確“從生活中來,到生活中去”的道理.
學習化學應該明確“從生活中來,到生活中去”的道理.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若c(CH3COOH)=0.1mol/L,反應后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反應后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反應后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反應后的溶液呈中性,則:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com