
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
分析 保持溫度、容器容積不變條件下,按照一定的配比將物質放入容器中,達平衡時C的含量仍為m%的,說明新的平衡與原平衡為等效平衡;只要按照化學計量數將各物質轉化成反應物,滿足n(A)=1mol、n(B)=1mol,則兩個平衡互為完全等效平衡,則達到平衡時C的含量仍為m%.
解答 解:該反應在恒溫恒容下,達到平衡后,C的含量仍為m%,說明兩反應為等效平衡,只要按照按化學計量數將各物質的量轉化到左邊,滿足n(A)=1mol,n(B)=1mol即可,
A.2molA和1molB,與1molA和1molB相比,A的物質的量多了1mol,平衡向著正向移動,則達到平衡時C的含量大于m%,故A錯誤;
B.1molC和1molD,按照化學計量數轉化成反應物,相當于加入了0.5molA、0.5molB和0.5molC,與原反應中1molA、1molB不互為等效平衡,達到平衡時C的含量不是w%,故B錯誤;
C.2molC和2molD,按照化學計量數轉化成反應物,相當于加入了1molA、1molB、1molC,和起始量不同,達到平衡時C的含量不是w%,故C錯誤;
D.0.5mol A+0.5mol B+0.5mol C+1mol D,按照化學計量數轉化成反應物,相當于1molA、1molB,兩個平衡為完全等效平衡,達到平衡時C的含量一定為m%,故D正確.
故選D.
點評 本題考查化學平衡的有關計算、等效平衡判斷,題目難度中等,構建平衡建立的途徑是解題關鍵,注意等效平衡規律:恒溫恒壓下,按化學計量數轉化到一邊,滿足對應物質的物質的量之比相同,為等效平衡;恒溫恒容下,若反應前后氣體氣體發生變化,按化學計量數轉化到一邊,滿足對應物質的物質的量相等,為等效平衡;若反應前后氣體的體積不變,按化學計量數轉化到一邊,滿足對應物質的物質的量之比相同,為等效平衡.


科目:高中化學 來源: 題型:填空題

 (1)FeCl3具有凈水作用,但腐蝕設備,FeCl3溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有凈水作用,但腐蝕設備,FeCl3溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示)2Fe3++Fe=3Fe2+.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
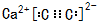 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | ① | ② | ③ | ④ |
| M(粉末樣品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反應后剩余固體)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 128gC60中含有90NA個分子 | |
| B. | 46g NO2和N2O4的混合氣體含有的原子數為3NA | |
| C. | 標準狀況下,22.4L CCl4所含的分子數為6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物質的量濃度為0.01 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
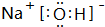 ,其中存在的化學鍵類型為離子鍵、共價鍵.
,其中存在的化學鍵類型為離子鍵、共價鍵.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com