
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)低溫下(此時水為液態)能自發進行,而正反應為氣體物質的量減小的反應,是熵減反應,△G=△H-T△S<0反應自發進行;
(2)計算濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行,進而判斷v正、v逆相對大小;
(3)根據v=$\frac{△c}{△t}$計算用CH3OCH3表示該反應的速率;
(4)可逆反應到達平衡時,同種物質的正逆速率相等,各組分的濃度、含量保持不變,由此衍生的氣體一些物理量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化,說明反應到達平衡;
(5)由表中數據可知,甲醇的起始濃度為(0.44+0.6×2)mol/L=1.64mol/L,設平衡時甲醇濃度變化量為xmol/L,則:
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L):1.64 0 0
變化量(mol/L):x 0.5x 0.5x
平衡量(mol/L):1.64-x 0.5x 0.5x
根據平衡常數列方程計算解答.
解答 解:(1)低溫下(此時水為液態)能自發進行,而正反應為氣體物質的量減小的反應,是熵減反應,△G=△H-T△S<0反應自發進行,則△H<0,故答案為:<;
(2)濃度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反應向正反應進行,則v正>v逆,
故答案為:>;濃度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反應向正反應進行;
(3)前5min內,用CH3OCH3表示該反應的速率為$\frac{0.6mol/L}{5min}$=0.12mol/(L.min),
故答案為:0.12mol/(L.min);
(4)A.反應前后氣體的物質的量不變,恒溫下容器中壓強始終不變,故A錯誤;
B.混合氣體中c(CH3OH)不變,說明到達平衡,故B正確;
C.v生成(CH3OH)=2v消耗(H2O)均為逆反應速率,反應開始后始終為該比例關系,故C錯誤;
D.甲醚與水的按物質的量1:1生成,二者濃度始終相等,故D錯誤,
故選:B;
(5)由表中數據可知,甲醇的起始濃度為(0.44+0.6×2)mol/L=1.64mol/L,設平衡時甲醇濃度變化量為xmol/L,則:
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L):1.64 0 0
變化量(mol/L):x 0.5x 0.5x
平衡量(mol/L):1.64-x 0.5x 0.5x
所以$\frac{0.5x×0.5x}{(1.64-x)^{2}}$=400,解得x=1.6,甲醇的轉化率為$\frac{1.6mol/L}{1.64mol/L}$×100%=97.6%,
故答案為:97.6%.
點評 本題考查化學平衡計算、反應速率計算、平衡狀態判斷、平衡常數應用等,注意掌握平衡常數的有關應用,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 單位體積溶液里所含的溶質的物質的量,叫做物質的量濃度 | |
| B. | 氣體摩爾體積就是22.4L mol- | |
| C. | 摩爾質量就是微粒的相對分子質量或者相對原子質量 | |
| D. | 物質的量就是物質的質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
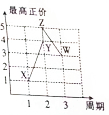 X、Y、Z、W、V是五種短周期主族元素,部分元素的周期序數與最高正價的關系如圖所示.已知V元素的原子序數是下一周期同族元素的原子序數的一半.
X、Y、Z、W、V是五種短周期主族元素,部分元素的周期序數與最高正價的關系如圖所示.已知V元素的原子序數是下一周期同族元素的原子序數的一半. 查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、H+、Cl-、OH- | B. | K+、H+、HCO3-、Cl- | ||
| C. | Fe2+、H+、Br-、OH- | D. | K+、NH4+、SO42-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com