
分析 (1)①根據酸堿中和滴定操作正確的操作步驟進行排序;
②氫氧化鈉與硫酸恰好中和溶液的pH為7,據此選擇指示劑;
③根據滴定結束前硫酸溶液的顏色及反應結束后混合液的顏色變化判斷滴定終點;
(2)堿式滴定管用蒸餾水潤洗后,未用標準液潤洗,則氫氧化鈉溶液的濃度變小;
觀察堿式滴定管讀數時,若滴定前仰視,則讀數偏大,滴定后俯視,則讀數偏小;
(3)根據滴定消耗的氫氧化鈉溶液的體積及反應方程式計算出待測液硫酸的物質的量濃度.
解答 解:(1)①用標準0.14mol/L NaOH溶液滴定硫酸的實驗操作步驟為:檢查滴定管是否漏水、洗滌滴定管、潤洗并盛裝標準液、潤洗盛裝標準液的滴定管、盛裝標準液、開始滴定、重復滴定等,所以正確的操作順序為:ECBADGF;
故答為:ECDBAGF;
②氫氧化鈉與硫酸恰好中和溶液的pH為7,可以選用酚酞(變色范圍為:8-10)作為指示劑,
故答案為:酚酞;
③滴定結束前,滴入酚酞的硫酸溶液為無色,滴定結束時,溶液變成紅色,所以滴定終點現象為:滴入最后一滴NaOH溶液,溶液突然變成紅色,半分鐘不褪色,
故答案為:滴入最后一滴NaOH溶液,溶液突然變成紅色,半分鐘不褪色;
(2)堿式滴定管用蒸餾水潤洗后,未用標準液潤洗,相當于標準液被稀釋,所以消耗掉的稀硫酸就會增多,滴定結果偏大,
故答案為:偏大;
觀察堿式滴定管讀數時,若滴定前仰視,則讀數偏大,滴定后俯視,則讀數偏小,兩個讀數差即是反應消耗的氫氧化鈉的體積,兩個讀數差偏小,即消耗的氫氧化鈉的體積偏小,求出硫酸的物質的量濃度偏小,
故答案為:偏小;
(3)根據反應:2NaOH+H2SO4=Na2SO4+2H2O,稀釋后的硫酸溶液濃度為:c(H2SO4)=$\frac{\frac{1}{2}×0.14mol/L×0.015L}{0.025L}$=0.042mol/L,
稀釋前稀硫酸的濃度為:0.042mol/L×$\frac{100mL}{1mL}$=4.20mol/L,
故答案為:4.20.
點評 本題考查了酸堿中和滴定實驗操作及誤差分析,熟記酸堿中和滴定的實驗步驟和注意事項,側重考查學生分析能力和實驗能力,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 6.75 g | B. | 4.05g | C. | 2.70 g | D. | 1.80 g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
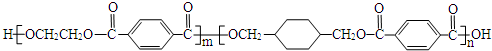
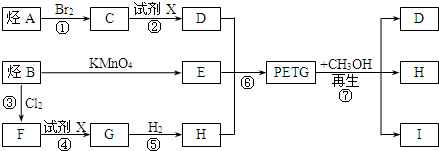
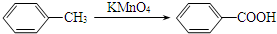
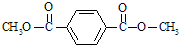 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
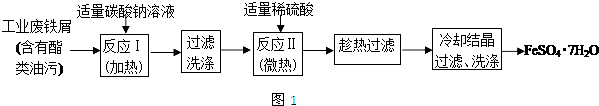

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
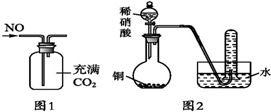
| A. | 汽車尾氣中有NOx,主要是汽車打火時氮氣和氧氣反應引起的 | |
| B. | 可以用圖1所示裝置收集到干燥的NO氣體 | |
| C. | 根據圖2裝置收集到的氣體為無色能夠驗證銅和稀硝酸反應的產物中氣態物質只有NO | |
| D. | 可以用濕潤的淀粉碘化鉀試紙鑒別紅棕色氣體NO2和溴蒸氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
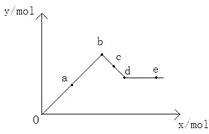
| A. | a-b時沉淀的物質的量:Al(OH)3比BaSO4多 | |
| B. | c-d時溶液中離子的物質的量:AlO2-比Ba2+多 | |
| C. | a-d時沉淀的物質的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e時溶液中離子的物質的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 X、Y、Z、W 均為中學化學中常見物質或其溶液,一定條件下它們之間有如下轉化關系(其它產物已略去),下列說法不正確的是( )
X、Y、Z、W 均為中學化學中常見物質或其溶液,一定條件下它們之間有如下轉化關系(其它產物已略去),下列說法不正確的是( )| A. | 若 W 是單質鐵,則 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸鈉,則 W 可能是鹽酸 | |
| C. | 若 W 是氫氧化鈉,則 X 與 Z 可反應生成 Y | |
| D. | 若 W 為氧氣,則 Z 與水反應(或溶于水)一定生成一種強酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
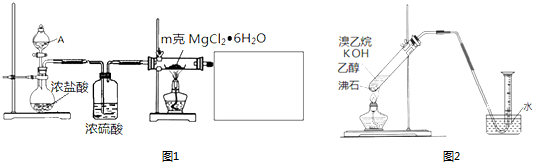
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com