
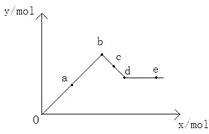
| A. | a-b時沉淀的物質的量:Al(OH)3比BaSO4多 | |
| B. | c-d時溶液中離子的物質的量:AlO2-比Ba2+多 | |
| C. | a-d時沉淀的物質的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e時溶液中離子的物質的量:Ba2+可能等于OH- |
分析 A.根據a-b是沉淀生成增大的過程,發生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,b點沉淀的物質的量最大以及所發生的反應來回答;
B.c-d發生反應2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O,Ba(AlO2)2電離出AlO2-、Ba2+;
C.a-b發生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,b~d中Al(OH)3沉淀逐漸溶解轉化為Ba(AlO2)2,據此來分析;
D.d點時Al(OH)3沉淀恰好完全溶解,此時溶液中只存在Ba(AlO2)2,當加入的Ba(OH)2的物質的量等于Ba(AlO2)2的物質的量時,溶液中Ba2+與OH-的量相等.
解答 解:A.在a-b發生反應A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,由方程式可知,沉淀的物質的量:Al(OH)3<BaSO4,故A錯誤;
B.c-d發生反應2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O,1molBa(AlO2)2電離出2molAlO2-、1molBa2+,故AlO2-比Ba2+多,故B正確;
C.a-b發生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,由方程式可知,沉淀的物質的量:Al(OH)3<BaSO4,b~d中Al(OH)3沉淀逐漸溶解轉化為Ba(AlO2)2,故a-d時沉淀的物質的量:BaSO4大于A1(OH)3,故C錯誤;
D.d點時Al(OH)3沉淀恰好完全溶解,此時溶液中只存在Ba[Al(OH)4]2,當加入的Ba(OH)2的物質的量等于Ba[Al(OH)4]2的物質的量時,溶液中Ba2+與OH-的量相等,故D正確;
故選BD.
點評 本題考查離子反應方程式及圖象的分析,為高頻考點,把握發生的離子反應及圖象中對應的離子反應為解答的關鍵,側重分析、應用能力的綜合考查,題目難度中等.


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:解答題

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 體積(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol NaCl 分子 | |
| B. | 質子數為 35、中子數為 45 的溴原子:${\;}_{35}^{45}$ Br | |
| C. | 硫離子的結構示意圖: | |
| D. | NH4+ 的電子式: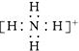 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 己二酸
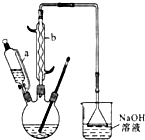
己二酸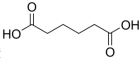 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下: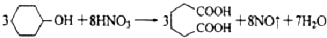
| 物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com