
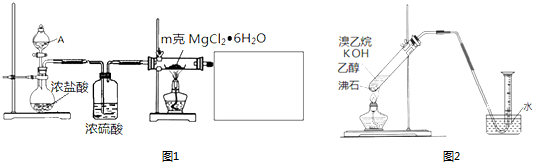
 .
.分析 (1)①②加熱氯化鎂晶體失去結晶水得到無水氯化鎂,由于氯化鎂易水解,應在HCl氛圍中加熱分解,A中液體為濃硫酸,與圓底燒瓶中濃鹽酸混合,發生大量的熱,利用HCl逸出,洗氣瓶中濃硫酸干燥HCl,利用氫氧化鈉溶液吸收尾氣中HCl,防止污染空氣,注意防止倒吸,還要防止氫氧化鈉溶液中水蒸氣導致氯化鎂水解,尾氣處理裝置與加熱裝置之間需要連接盛放氯化鈣的干燥管(或盛放濃硫酸的洗氣瓶);
③稱量加熱后固體的質量可以判斷氯化鎂晶體是否完全分解;
(2)①乙醇在濃硫酸作用下發生消去反應生成乙烯,反應中會發生副反應,有二氧化碳、二氧化硫生成,用氫氧化鈉溶液吸收除去二氧化碳、二氧化硫,液體加熱需要防止暴沸,還需要加入沸石;
②方案中利用溴乙烷發生消去反應生成乙烯,利用圖中裝置制備乙烯,實驗結果是量筒內壁附著較多無色油狀液體,且得到很少量的氣體,說明生成乙烯很少,大量的溴乙烷揮發,可以可以增加冷凝回流裝置,有利于溴乙烷冷凝回流,可以利用水浴加熱控制反應溫度,減少溴乙烷揮發.
解答 解:(1)加熱氯化鎂晶體失去結晶水得到無水氯化鎂,由于氯化鎂易水解,應在HCl氛圍中加熱分解,A中液體為濃硫酸,與圓底燒瓶中濃鹽酸混合,發生大量的熱,利用HCl逸出,洗氣瓶中濃硫酸干燥HCl,利用氫氧化鈉溶液吸收尾氣中HCl,防止污染空氣,注意防止倒吸,還要防止氫氧化鈉溶液中水蒸氣導致氯化鎂水解,尾氣處理裝置與加熱裝置之間需要連接盛放氯化鈣的干燥管(或盛放濃硫酸的洗氣瓶);
①由上述分析可知,分液漏斗中的A物質是濃硫酸,故答案為:濃硫酸;
②利用氫氧化鈉溶液吸收尾氣中HCl,防止污染空氣,且防止倒吸,還要在尾氣處理裝置與加熱裝置之間需要連接盛放氯化鈣的干燥管(或盛放濃硫酸的洗氣瓶),防止氯化鎂水解,需要補充完整實驗裝置為: 等,
等,
故答案為: 等;
等;
③實驗過程中MgCl2?6H2O未水解,mg晶體的物質的量為$\frac{m}{203}$mol,完全分解得到氯化鎂為$\frac{m}{203}$mol×95g/mol=$\frac{95m}{203}$g,稱量所得產物質量,若質量為$\frac{95m}{203}$g,說明MgCl2?6H2O完全轉化為MgCl2,否則未完全,
故答案為:稱量所得產物質量,若質量為$\frac{95m}{203}$g,說明MgCl2?6H2O完全轉化為MgCl2,否則未完全;
(2)①乙醇在濃硫酸作用下發生消去反應生成乙烯,反應方程式為:CH3CH2OH$→_{170℃}^{濃硫酸}$CH2=CH2↑+H2O,
反應中會發生副反應,有二氧化碳、二氧化硫生成,用氫氧化鈉溶液吸收除去二氧化碳、二氧化硫,液體加熱需要防止暴沸,還需要加入沸石,除乙醇外,所需的試劑或用品(不包括儀器)有:濃硫酸、氫氧化鈉溶液、沸石,
故答案為:CH3CH2OH$→_{170℃}^{濃硫酸}$CH2=CH2↑+H2O;濃硫酸、氫氧化鈉溶液、沸石;
②方案中利用溴乙烷發生消去反應生成乙烯,利用圖中裝置制備乙烯,實驗結果是量筒內壁附著較多無色油狀液體,且得到很少量的氣體,說明生成乙烯很少,大量的溴乙烷揮發,
氣體產率很低的原因主要是:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;
為增大氣體產率,可以增加冷凝回流裝置,有利于溴乙烷冷凝回流,可以利用水浴加熱,便于控制溫度等,減少溴乙烷揮發,
故答案為:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;增加冷凝回流裝置等.
點評 本題考查化學實驗制備,屬于拼合型題目,明確制備原理是解題關鍵,側重考查學生對原理、裝置、操作的分析評價,是對學生綜合能力的考查,難度中等.


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 65g鋅與足量稀硫酸反應產生的氣體體積為22.4L | |
| B. | 標準狀況下,以任意比混合的H2和CO氣體共8.96L,在足量氧氣中充分燃燒時消耗氧氣的分子數為0.2NA | |
| C. | 0.2mol H2O2在MnO2催化下充分反應生成O2的數目為0.2NA | |
| D. | 同溫同壓下,1mol H2在空氣中充分燃燒,消耗O2的體積為22.4L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 碘被稱為“智力元素”,科學合理地補充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘鹽中.
碘被稱為“智力元素”,科學合理地補充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘鹽中.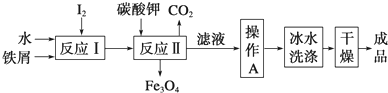
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將磁性氧化鐵溶于鹽酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入過量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“潔廁靈”(主要成分為鹽酸)混合使用會產生有毒氣體:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
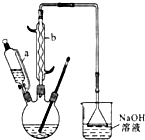 己二酸
己二酸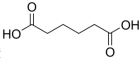 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下: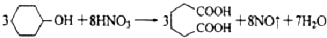
| 物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量懸濁液,過濾,充分洗滌后,取濾渣于試管中,:加入過量2mol/L的鹽酸溶液,充分振蕩,再滴加幾滴0.1mol/L氯化鋇溶液 | 有白色沉淀生成說明懸濁液中混有Cu4(OH)6SO4. |
| 步驟2:另取少量懸濁液于試管中,將試管放入裝有沸水的小燒杯中水浴加熱一段時間取出試管觀察 | 試管中有黑色固體生成,說明懸濁液中混有Cu(OH)2. |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com