
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化產物與還原產物的物質的量之比為l:1 | |
| C. | 消耗l mol還原劑,轉移5 mol電子 | |
| D. | 凈化1 L含CN-1.04 mg•L-1的廢水,理論上需用2×l0-5mol C1O2 |
分析 二氧化氯(ClO2)能凈化有毒廢水中的氰化鈉(NaCN),生成NaCl、CO2和N2,反應中Cl元素的化合價由+4降低為-1價,被還原,生成還原產物,N元素的化合價由-3價升高為0,C元素的化合價由+2價升高為+4價,被氧化,生成氧化產物,則根據得失電子守恒,反應的離子方程式為:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,以此解答.
解答 解:A.C、N元素化合價都升高,被氧化,故A錯誤;
B.根據以上分析,反應的離子方程式為:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,C、N元素化合價都升高,則氧化產物有N2、CO2,Cl元素的化合價由+4降低為-1價,則還原產物為Cl-,所以氧化產物與還原產物的物質的量之比為3:2,故B錯誤;
C.由反應可知,消耗l mol還原劑即l molCN-,轉移4-2+3=5 mol電子,故C正確;
D.根據以上分析,反應的離子方程式為:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,所以凈化1 L含CN-1.04 mg•L-1的廢水,理論上需用$\frac{1.04×10{\;}^{-3}g/L×1L}{26g/mol}$=4.0×10-5mol C1O2,故D錯誤.
故選C.
點評 本題考查氧化還原反應的計算,為高頻考點,把握反應中元素的化合價變化及氧化還原反應中規律性知識為解答的關鍵,選項D為解答的易錯點,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸和堿反應生成1mol水時所放出的熱 | |
| B. | 1mol酸和1mol堿反應生成鹽和水時所放出的熱 | |
| C. | 強酸稀溶液和強堿稀溶液反應生成1mol液態水時所放出的熱 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反應生成1mol水時所放出的熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
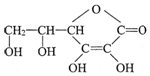 ,分子式為C6H8O6;其中的-OH叫羥基(填官能團名稱).在維生素C溶液中滴入少量藍色的含有淀粉的碘水,可觀察到的現象是藍色褪去,說明維生素C有還原性(填氧化性或還原性).
,分子式為C6H8O6;其中的-OH叫羥基(填官能團名稱).在維生素C溶液中滴入少量藍色的含有淀粉的碘水,可觀察到的現象是藍色褪去,說明維生素C有還原性(填氧化性或還原性).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 防止廢舊電池重金屬鹽對土壤水資源造成污染,大力開發廢舊電池綜合利用技術 | |
| B. | 為減少北方霧霾,作物秸稈禁止直接野外燃燒,研究開發通過化學反應轉化為乙醇用作汽車燃料 | |
| C. | 為節約垃圾處理的費用,大量采用垃圾的填埋 | |
| D. | 為減少溫室氣體排放,應減少燃煤.大力發展新能源,如核能、風能、太陽能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
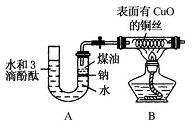 某課外活動小組為了檢驗鈉與水反應的產物,設計如圖裝置(夾持裝置省略).首先在U形管內加入少量煤油和兒粒鈉塊,再從U形管高端加入水(含有酚酞),趕出空氣,一會兒點燃酒精燈加熱銅絲.
某課外活動小組為了檢驗鈉與水反應的產物,設計如圖裝置(夾持裝置省略).首先在U形管內加入少量煤油和兒粒鈉塊,再從U形管高端加入水(含有酚酞),趕出空氣,一會兒點燃酒精燈加熱銅絲.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
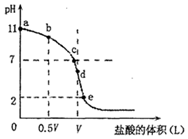 c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)
c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)查看答案和解析>>
科目:高中化學 來源: 題型:填空題
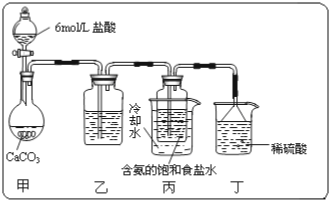
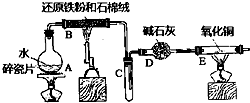 某校化學小組學生利用如圖所列裝置進行“鐵與水反應”的實驗,并進行了其他有關實驗.(圖中夾持及尾氣處理裝置均已略去)
某校化學小組學生利用如圖所列裝置進行“鐵與水反應”的實驗,并進行了其他有關實驗.(圖中夾持及尾氣處理裝置均已略去)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com