
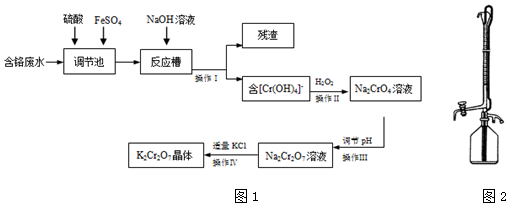
分析 含鉻廢水(Cr2O72-和Cr3+)加入硫酸和硫酸亞鐵,進入調節池發生氧化還原反應產生鐵離子和鉻離子,加入氫氧化鈉溶液過濾得到濾渣為氫氧化鐵沉淀,濾液含Cr(OH)4-,加入過氧化氫酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ調節溶液PH,使反應2CrO42-+2H+?Cr2O72-+H2O向正方向移動,酸溶液應選擇硫酸,鹽酸易被氧化所以不選擇鹽酸,得到的Na2Cr2O7溶液,加入適量KCl過濾得到K2Cr2O7晶體,據此解答.
解答 解:含鉻廢水(Cr2O72-和Cr3+)加入硫酸和硫酸亞鐵,進入調節池發生氧化還原反應產生鐵離子和鉻離子,加入氫氧化鈉溶液過濾得到濾渣為氫氧化鐵沉淀,濾液含Cr(OH)4-,加入過氧化氫酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ調節溶液PH,使反應2CrO42-+2H+?Cr2O72-+H2O向正方向移動,酸溶液應選擇硫酸,鹽酸易被氧化所以不選擇鹽酸,得到的Na2Cr2O7溶液,加入適量KCl過濾得到K2Cr2O7晶體.
(1)調節池里發生的反應是酸性溶液中重鉻酸跟離子氧化亞鐵離子生成鐵離子的反應,反應的離子方程式為:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,
故答案為:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)分析可知,操作Ⅰ得到的殘渣為氫氧化鐵,化學式為:Fe(OH)3,故答案為:Fe(OH)3;
(3)根據2CrO42-+2H+?Cr2O72-+H2O,以及實驗目的,應加入酸,促使平衡向正反應方向進行,石灰乳的主要成分是氫氧化鈣,碳酸鈉溶液呈堿性,CD都會使平衡逆向移動,故C、D錯誤,因為Cr2O72-具有強氧化性,能把Cl-氧化成Cl2,故選項A錯誤,
故答案為:B;根據2CrO42-+2H+?Cr2O72-+H2O,以及實驗目的,應加入酸,促使平衡向正反應方向進行,故C、D錯誤;因為Cr2O72-具有強氧化性,能把Cl-氧化成Cl2,故選項A錯誤;
(4)①自動定零位滴定管使得測定結果更準確,操作簡單,滴定時采用如圖2所示的側邊自動定零位滴定管,具有的優點是:操作簡單,無視力誤差,計算精確,
故答案為:操作簡單,無視力誤差,計算精確;
②Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
反應定量關系為:Cr2O72-→2Cr3+~2H4Y(EDTA)
n(Cr3+)=n(EDTA)=amol•L-1×b×10-3L=ab×10-3mol,
計算得到鉻離子的濃度=$\frac{ab×1{0}^{-3}mol×52g/mol}{0.1L}$=0.52abg/L=520abmg/L,
故答案為:520ab.
點評 本題考查了物質分離提純的方法和實驗基本操作、滴定實驗的分析和計算,主要是物質性質和化學平衡的理解應用,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
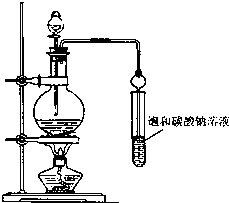 實驗室合成乙酸乙酯粗產品的步驟如下:在蒸餾燒瓶內將過量的乙醇和少量濃H2SO4混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾,直接收集蒸餾產品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗產品.據此回答問題:
實驗室合成乙酸乙酯粗產品的步驟如下:在蒸餾燒瓶內將過量的乙醇和少量濃H2SO4混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾,直接收集蒸餾產品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗產品.據此回答問題: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
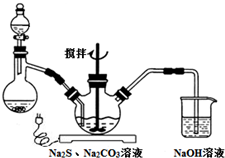 NaCN為劇毒無機物.某興趣小組查資料得知,實驗室里的NaCN溶液可用Na2S2O3溶液進行解毒銷毀,他們開展了以下三個實驗,請根據要求回答問題:
NaCN為劇毒無機物.某興趣小組查資料得知,實驗室里的NaCN溶液可用Na2S2O3溶液進行解毒銷毀,他們開展了以下三個實驗,請根據要求回答問題:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 已知乙酸和乙醇在濃硫酸催化下會發生下列反應:
已知乙酸和乙醇在濃硫酸催化下會發生下列反應:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化產物與還原產物的物質的量之比為l:1 | |
| C. | 消耗l mol還原劑,轉移5 mol電子 | |
| D. | 凈化1 L含CN-1.04 mg•L-1的廢水,理論上需用2×l0-5mol C1O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對2HI(g)?H2(g)+I2(g)平衡體系增加壓強使顏色變深 | |
| B. | 反應CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高溫度使平衡向逆方向移動 | |
| C. | 合成氨反應:N2(g)+3H2(g)?2NH3(g)△H<0,為使氨的產率提高,理論上應采取低溫高壓的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),當加入NaOH溶液后顏色變淺 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com