
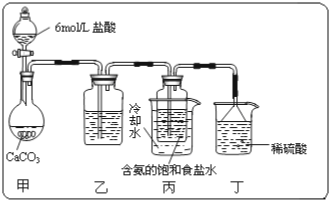
分析 (1)甲裝置用于制備二氧化碳,二氧化碳中混有氯化氫,則乙為飽和碳酸氫鈉溶液,用于除去氯化氫,二氧化碳和氨水在丙中發生反應NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl,生成碳酸氫鈉,丁中稀硫酸用于吸收氨氣,防止污染空氣;
(2)碳酸氫鈉分解生成碳酸鈉,碳酸氫鈉、碳酸鈉與石灰水反應生成碳酸鈣,根據碳酸鈣的質量可列方程式確定碳酸鈉的質量和質量分數.
解答 解:(1)①實驗室用氫氧化鈣和氯化銨在加熱條件下反應制備氨氣,反應的化學方程式為Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
②利用鹽酸制取二氧化碳時,因鹽酸易揮發,所以,二氧化碳中常會含有氯化氫氣體,碳酸氫鈉能與鹽酸反應不與二氧化碳反應,所以通過碳酸氫鈉的溶液是可以除掉二氧化碳氣體中的氯化氫氣體,實驗過程中氨氣可能有剩余,而稀硫酸能與氨氣反應,所以稀硫酸的作用是吸收末反應的NH3,
故答案為:飽和碳酸氫鈉溶液;吸收未反應完的 NH3;
③分離出NaHCO3晶體的操作是分離固體與液體,常采用的實驗操作是過濾操作,常用到的儀器有玻璃棒、燒杯和漏斗,故答案為:過濾; 漏斗、燒杯;
(2)碳酸氫鈉受熱發生的反應為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,與足量的石灰水充分反應,
NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
反應生成的碳酸鈣物質的量為:$\frac{12g}{100g/mol}$=0.12mol;
設加熱后的固體12.28g中含碳酸鈉物質的量x、碳酸氫鈉物質的量為y,依據題意得到:
①x+y=0.12、②106x+84y=12.28,
根據①②解得:x=0.1mol、y=0.02mol,
則所得固體中碳酸鈉的質量分數為:$\frac{0.1mol×106g/mol}{12.28g}$×100%=86.3%,
故答案為:86.3%.
點評 本題考查性質實驗方案的設計,是一道有關工業制純堿知識的一道綜合實驗題目,為高頻考點,題目難度中等,考查學生分析和解決問題的能力,掌握制堿原理是解題的關鍵.


 小學生10分鐘口算測試100分系列答案
小學生10分鐘口算測試100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
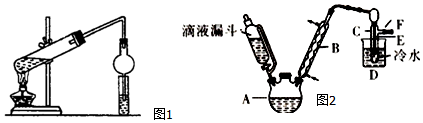
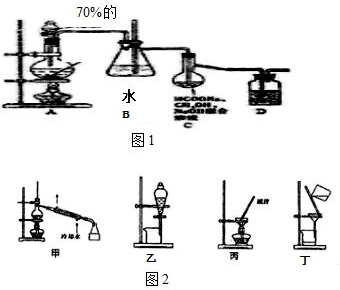
 在實驗室我們用如圖所示的裝置制取乙酸乙酯.回答下列問題:
在實驗室我們用如圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
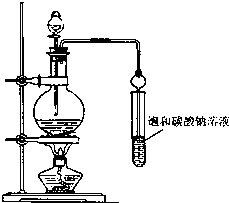 實驗室合成乙酸乙酯粗產品的步驟如下:在蒸餾燒瓶內將過量的乙醇和少量濃H2SO4混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾,直接收集蒸餾產品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗產品.據此回答問題:
實驗室合成乙酸乙酯粗產品的步驟如下:在蒸餾燒瓶內將過量的乙醇和少量濃H2SO4混合,然后經分液漏斗邊滴加醋酸,邊加熱蒸餾,直接收集蒸餾產品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗產品.據此回答問題: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 乙醇 | 溴乙烷 | 溴 | |
| 狀態 | 無色液體 | 無色液體 | 深紅棕色液體 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸點/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
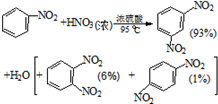
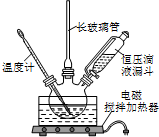 硝基苯是醫藥和染料的中間體,還可做有機溶劑.反應如圖:
硝基苯是醫藥和染料的中間體,還可做有機溶劑.反應如圖: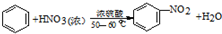
| 物質 | 熔點/ ℃ | 沸點 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 難溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |
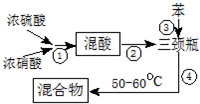

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化產物與還原產物的物質的量之比為l:1 | |
| C. | 消耗l mol還原劑,轉移5 mol電子 | |
| D. | 凈化1 L含CN-1.04 mg•L-1的廢水,理論上需用2×l0-5mol C1O2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com