
| 操作 | 現象 |
| 取4g漂粉精固體,加入100mL水 | 部分固體溶解,溶液略有顏色 |
| 過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
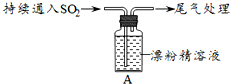 | i.液面上方出現白霧; ⅱ.稍后,出現渾濁,溶液變為黃綠色; ⅲ.稍后,產生大量白色沉淀,黃綠色褪去 |
分析 (1)①反應中生成Cl2,用濕潤的碘化鉀淀粉試紙檢驗白霧中是否Cl2,排除Cl2干擾;②白霧中含有SO2,可以被硝酸氧化為硫酸,故SO2可以使酸化的AgNO3溶液產生白色沉淀;
(2)依據次氯酸根離子和氯離子在酸溶液中會發生歸中反應生成氯氣,向漂粉精溶液中逐滴滴入硫酸,觀察溶液顏色是否變為黃綠色;
(3)二氧化硫通入漂白精溶液中,形成酸溶液,次氯酸根離子具有強氧化性可以氧化二氧化硫為硫酸和鈣離子形成硫酸鈣沉淀;二氧化硫繼續通入后和生成的氯氣發生反應生成硫酸和鹽酸.
解答 解:(1)向水中持續通入SO2,未觀察到白霧.推測現象的白霧由HCl小液滴形成,
①用濕潤的碘化鉀淀粉試紙檢驗白霧,無變化;為了檢驗白霧中是否含有氯氣,因為含有氯氣在檢驗氯化氫存在時產生干擾,
故答案為:檢驗白霧中是否含有Cl2,排除Cl2干擾;
②用酸化的AgNO3溶液檢驗白霧,產生白色沉淀,若含有二氧化硫氣體,通入硝酸酸化的硝酸銀溶液,會被硝酸氧化為硫酸,硫酸和硝酸銀反應也可以生成硫酸銀沉淀,所以通過實驗不能證明一定含有氯化氫,
故答案為:白霧中混有SO2,SO2可與酸化的AgNO3反應產生白色沉淀;
(2)現象ⅱ中溶液變為黃綠色的可能原因:隨溶液酸性的增強,漂粉精的有效成分和Cl-發生反應.通過進一步實驗確認了這種可能性,漂粉精中成分為次氯酸鈣、氯化鈣,次氯酸根具有強氧化性在酸性溶液中可以氧化氯離子為氯氣,
故答案為:向漂粉精溶液中逐滴加入硫酸,觀察溶液是否變為黃綠色;
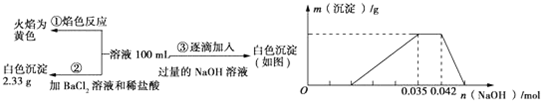
(3)①取上層清液,加入BaC12溶液,產生白色沉淀,說明SO2被氧化為SO42-,故沉淀X為CaSO4;
②溶液呈黃綠色,有Cl2生成,Cl2與SO2反應生成鹽酸與硫酸;反應的離子方程式為:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,
故答案為:CaSO4:SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
點評 本題考查了二氧化硫性質的綜合應用,性質的實驗驗證方法和實驗判斷,漂白精的成分中次氯酸鈣和氯化鈣在酸溶液中會發生氧化還原反應生成氯氣,注意物質的檢驗方法,題目難度較大.


 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3穩定 | |
| C. | Na2CO3溶液比NaHCO3溶液堿性強 | |
| D. | 碳酸鈉與鹽酸反應放出二氧化碳的劇烈程度強于碳酸氫鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,17 g NH3中含有的電子總數為10NA | |
| B. | 常溫常壓下,14g的C2H4和C3H6混合氣體含有的氫原子數為2NA | |
| C. | 常溫常壓下,22.4 L氯氣與足量鎂粉充分反應,轉移的電子數為2NA | |
| D. | 標準狀況下,22.4 L 的N2O和CO2混合氣體中含有的電子總數為22NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚丙烯的結構簡式: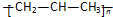 | B. | 二氧化碳的電子式: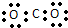 | ||
| C. | 中子數為18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
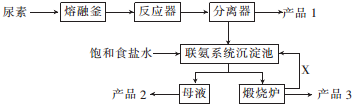
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
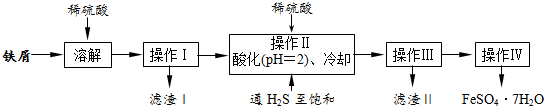
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com