
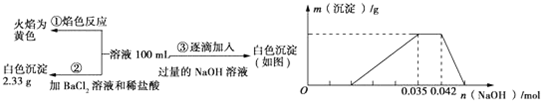
分析 無色廢水確定無Fe3+,根據實驗①確定有Na+,根據實驗②確定有SO42-,根據實驗③確定有Al3+,一定不含Fe3+、Mg2+,因為CO32-與Al3+不能共存,所以無CO32-;故溶液中存在的離子為:Al3+、NH4+、H+、SO42-,根據硫酸鋇沉淀求出n(SO42-),根據圖象求出n(Al3+)和n(H+),再根據電荷守恒確定有沒有NO3-.
解答 解:(1)無色廢水確定無Fe3+,根據實驗①確定有Na+,根據實驗②確定有SO42-,根據實驗③確定有Al3+,一定不含Fe3+、Mg2+,因為CO32-與Al3+不能共存,所以無CO32-;故溶液中存在的離子為:Na+、Al3+、NH4+、H+、SO42-,廢水中一定不存在的離子有Fe3+、Mg2+、CO32-,故答案為:Fe3+、Mg2+、CO32-;
(2)圖中依次發生的是中和反應,離子反應式為H++OH-=H2O,生成沉淀離子反應式為Al3++3OH-=Al(OH)3↓,再生成一水合氨,離子反應為NH4++OH-=NH3•H2O,最后氫氧化鋁能溶于氫氧化鈉中,即Al(OH)3+OH-=AlO2-+2H2O,故答案為:H++OH-=H2O、Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O;
(3)已知硫酸鋇沉淀為2.33g,則n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,
根據圖象可知與Al(OH)3的OH-為:n(OH-)=0.007mol,
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
所以n(Al3+)=0.007mol,將鋁離子沉淀需要氫氧化鈉0.021mol,所以溶液中H+消耗氫氧化鈉0.014mol,氫離子的物質的量是0.014mol,
NH4++OH-=NH3•H2O,消耗氫氧化鈉0.007mol,所以銨根離子的物質的量是0.007mol,原溶液中c(NH4+)與c(Al3+)的比值為1:1,
有于鈉離子的量無法確定,所以根據電荷守恒,無法確定是否在存在硝酸根離子,
故答案為:1:1;不確定.
點評 本題考查了常見離子檢驗,現象的判斷和離子檢驗,關鍵是圖象分析離子特征和離子共存的判斷,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬既可用于凈水,又可殺菌消毒 | |
| B. | 潔廁劑和漂白精不能混合使用,否則易產生有毒氣體 | |
| C. | 雙氧水可用于殺菌、消毒、漂白 | |
| D. | 家中發生天然氣泄漏,不能在室內用電話報警 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 向FeI2溶液中不斷通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物質的量隨n(Cl2)/n(FeI2)(即Cl2與FeI2的物質的量之比)的變化可用如圖簡單表示(“-”表示鐵各種價態的變化,用“-•-”表示碘各種形態的變化).下列結論錯誤的是( )
向FeI2溶液中不斷通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物質的量隨n(Cl2)/n(FeI2)(即Cl2與FeI2的物質的量之比)的變化可用如圖簡單表示(“-”表示鐵各種價態的變化,用“-•-”表示碘各種形態的變化).下列結論錯誤的是( )| A. | Cl2、I2、IO3-、Fe3+的氧化性依次減小 | |
| B. | 當$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=1.2時,反應的離子方程式為2Fe2++10I-+6Cl2═5I2+2Fe3++12Cl- | |
| C. | 當$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=6.5時,溶液中$\frac{n(C{l}^{-})}{n(I{O}_{3}^{-})}$=6.5 | |
| D. | 若溶液的體積不變,則溶液的pH減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 步驟 | 操作 | 現象 |
| (1) | 用紫色石蕊試液檢驗 | 溶液變紅 |
| (2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
| (3) | 將(2)中所得混合物過濾,向濾液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
| A. | 肯定含有的離子是②③⑥ | B. | 肯定沒有的離子是④⑤ | ||
| C. | 可能含有的離子是①③ | D. | 可能含有的離子是① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用灼燒的方法區別絲綢與棉布 | |
| B. | 可用焰色反應區別硫酸鈉和硫酸鉀 | |
| C. | 可用結晶的方法分離乙酸(沸點118℃)和乙酸乙酯(沸點77.1℃) | |
| D. | 可用分液的方法分離汽油和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 操作 | 現象 |
| 取4g漂粉精固體,加入100mL水 | 部分固體溶解,溶液略有顏色 |
| 過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
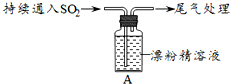 | i.液面上方出現白霧; ⅱ.稍后,出現渾濁,溶液變為黃綠色; ⅲ.稍后,產生大量白色沉淀,黃綠色褪去 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com