
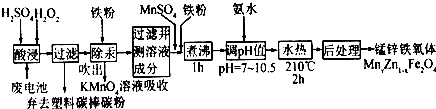
分析 廢電池酸浸得到濾液中液中主要金屬陽離子有Mn2+、Hg2+、Zn2+,加入鐵粉除Hg,吹出汞蒸汽經KMnO4溶液吸收,除汞后的濾液中含有硫酸鋅、硫酸亞鐵、硫酸錳等,加入MnSO4和鐵粉,調節濾液離子的成分,煮沸除去雙氧水,再水熱,進行后處理,也能得到錳鋅鐵氧體,
(1)酸浸時,雙氧水被氧化生成氧氣,二氧化錳還原生成硫酸錳,反應還有水生成;
(2)利用鐵粉把Hg還原出來;
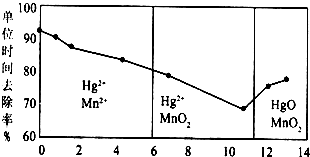
(3)①由圖可知,pH<6時Hg與酸性高錳酸鉀反應生成Hg2+、Mn2+;
②由圖可知,隨pH值的升高汞的去除率先降低后增加;
③酸性條件下有Mn2+生成,可能是Mn2+具有催化作用;
(4)Mn為+2價、Zn為+2價,利用化合價代數和為0,計算Fe元素化合價,再結合Mg、Zn、Fe原子數目之比改寫為氧化物形式;
(5)除汞后的濾液中含有硫酸鋅、硫酸亞鐵、硫酸錳、硫酸等,不加入MnSO4和鐵粉,進行后續操作,也能得到錳鋅鐵氧體,而實際中加入需加入一定量的MnSO4和鐵粉,應是調節濾液離子的成分,符合水熱后獲得錳鋅鐵氧化體組成.
解答 解:(1)酸浸時,雙氧水被氧化生成氧氣,二氧化錳還原生成硫酸錳,反應還有水生成,反應方程式為:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案為:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)鐵粉具有還原性,能把汞離子還原為汞單質,所以鐵粉的作用是還原劑,故答案為:還原劑;
(3)①由圖可知,pH<6時Hg與酸性高錳酸鉀反應生成Hg2+、Mn2+,反應離子方程式為:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案為:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由圖象可知,汞的吸收率隨著PH的增大先降低后增加,
故答案為:隨pH的升高汞的吸收率先降低后增加;
③不考慮酸性條件下氧化性增強因素,酸性條件下有Mn2+生成,可能是Mn2+具有催化作用,強酸性環境下汞的單位時間去除率高,
故答案為:Mn2+ 具有催化作用,單位時間內去除率高;
(4)Mn為+2價、Zn為+2價,當x=0.2時,利用化合價代數和為0,可知Fe元素化合價為+3,改寫為氧化物形式為:MnO•4ZnO•5Fe2O3,
故答案為:MnO•4ZnO•5Fe2O3;
(5)除汞后的濾液中含有硫酸鋅、硫酸亞鐵、硫酸錳、硫酸等,不加入MnSO4和鐵粉,進行后續操作,也能得到錳鋅鐵氧體,而實際中加入需加入一定量的MnSO4和鐵粉,應是調節濾液離子的成分,符合水熱后獲得錳鋅鐵氧化體組成,
故答案為:調節濾液離子的成分,符合水熱后獲得錳鋅鐵氧化體組成.
點評 本題考查化學工藝流程、物質的分離提純、對操作的分析評價、讀圖獲取信息能力等,側重考查學生對知識的遷移運用,難度中等.


 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:解答題
 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表現出多種氧化態,含第ⅤA族元素的化合物在研究和生產中有許多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表現出多種氧化態,含第ⅤA族元素的化合物在研究和生產中有許多重要用途. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl | B. | FeCl2 | C. | KOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol Na2O2中含有的陰離子數為2NA | |
| B. | 標準狀況下,由H2O2制得2.24LO2轉移的電子數目為0.4NA | |
| C. | 常溫常壓下,8g O3含有4 NA個電子 | |
| D. | 常溫下,1L pH=2的H2SO4溶液中含有的H+數目為0.02NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
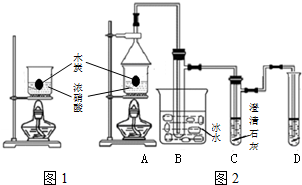 濃硝酸是一種常見的酸,加熱或見光易分解生成NO2.某實驗小組欲探究碳與濃硝酸的反應情況.實驗裝置如圖.回答下列問題:
濃硝酸是一種常見的酸,加熱或見光易分解生成NO2.某實驗小組欲探究碳與濃硝酸的反應情況.實驗裝置如圖.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | N2(g)+3H2(g)?2NH3(g);△H=2(b-a) kJ/mol | |
| B. | N2(g)+3H2(g)?2NH3(l);△H=2(a-b-c) kJ/mol | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(l);△H=(b+c-a) kJ/mol | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g);△H=(a+b) kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用丁達爾效應可以區分溶液和膠體 | |
| B. | 加熱飽和FeCl3溶液可制取Fe(OH)3膠體 | |
| C. | 利用焰色反應可以鑒別NaCl、KNO3、Na2SO4 | |
| D. | 用Ca(OH)2溶液可以區分Na2CO3和NaHCO3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com