
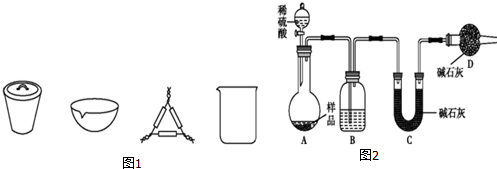
分析 [方案一]碳酸氫鈉不穩定,受熱易分解,根據加熱前后固體質量變化,根據差量法求碳酸氫鈉的質量,進而求得碳酸鈉的質量分數;
(1)在灼燒固體樣品時必須在坩堝中進行,根據使用坩堝加熱使用到的儀器答題;
(2)加熱恒重保證碳酸氫鈉完全分解;
(3)若加熱過程中有晶體迸濺出來,使得剩余的固體質量偏小,據此答題;
[方案二](1)由測定含量的實驗可知,A中發生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中為濃硫酸吸收水,干燥二氧化碳,利用C裝置吸收二氧化碳,D裝置防止空氣中的二氧化碳、水進入C裝置干擾含量測定,鹽酸易揮發,對實驗產生干擾;
(2)結合反應定量關系和元素守恒計算得到物質的質量,來計算物質含量;
(3)二氧化碳氣體不能全部進入C裝置被吸收,需要添加一個吧二氧化碳氣體趕入裝置C的裝置.
解答 解:[方案一](1)在灼燒固體樣品時必須在坩堝中進行,要用泥三角支撐,
故答案為:坩堝、泥三角;
(2)實驗原理是根據加熱前后固體質量變化來計算碳酸氫鈉,故應保證碳酸氫鈉完全分解,加熱恒重則碳酸氫鈉完全分解,
故答案為:保證NaHCO3分解完全;
(3)若加熱過程中有晶體迸濺出來,使得剩余的固體質量偏小,即計算得碳酸氫鈉的質量偏大,所以計算得樣品中Na2CO3的質量分數偏小,
故答案為:偏小;
[方案二](1)空氣中的水蒸氣和二氧化碳會被堿石灰吸收,故D的作用是吸收空氣中的水蒸氣和二氧化碳,以確保C裝置中質量增加量的準確性;分液漏斗中如果用鹽酸代替硫酸,鹽酸易揮發,這樣制得二氧化碳氣體中含氯化氫,濃硫酸不能吸收氯化氫,則氯化氫被堿石灰吸收,導致測到二氧化碳質量偏高,等質量碳酸鈉和碳酸氫鈉,碳酸氫鈉產生二氧化碳多,則會導致碳酸氫鈉偏多,碳酸鈉偏小,
故答案為:濃H2SO4;防止空氣中的水蒸氣、二氧化碳進入C裝置;不能;
(2)設NaHCO3和Na2CO3的物質的量分別為x、y,則
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
106x+84y=17.90
44x+44y=8.80
,解得x=0.05mol
y=0.15mol
則樣品中Na2CO3的質量分數為$\frac{0.05mol×106g/mol}{17.90g}$×100%=29.6%,
故答案為:29.6%;
(3)實驗裝置還存在一個明顯缺陷為裝置中的二氧化碳不能被C全部吸收,則需設計一個裝置將A、B中的CO2全部吹入C中吸收,
故答案為:缺少一個驅趕殘留二氧化碳氣體的裝置.
點評 本題考查碳酸鈉含量的測定實驗,為高頻考點,把握實驗裝置的作用及實驗目的為解答的關鍵,側重分析、計算及實驗能力的綜合考查,題目難度中等.


 學而優暑期銜接南京大學出版社系列答案
學而優暑期銜接南京大學出版社系列答案 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 這是一個氧化還原反應,Na2O2既是氧化劑,又是還原劑 | |
| B. | 這是一個氧化還原反應,Na2O2是氧化劑,CO2是還原劑 | |
| C. | 這是一個氧化還原反應,Na2O2是還原劑,CO2是氧化劑 | |
| D. | 這是一個置換反應,有單質O2產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:4 | B. | 1:2:3 | C. | 3:2:1 | D. | 2:5:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3molNO2和0.3molNO | |
| B. | 0.1mol NO、0.2molNO2和0.05mol N2O4 | |
| C. | 0.2molNO2 和0.1molN2O4 | |
| D. | 0.6molNO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液氯可以裝入鋼瓶中貯存 | |
| B. | 氯水可漂洗衣服上的墨漬 | |
| C. | 實驗室使用的氯水要裝在棕色瓶中,并且隨配隨用 | |
| D. | 實驗室可利用強氧化劑如KMnO4、KClO3等與濃HCl反應的原理制Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com