
| A. | Na2CO3可溶,NaHCO3難溶 | |
| B. | 可用Ca(OH)2溶液鑒別Na2CO3和NaHCO3兩種溶液 | |
| C. | Na2CO3中的NaHCO3可通過加熱的方法除去 | |
| D. | Na2CO3不能轉化成與NaHCO3,而NaHCO3能轉化為Na2CO3 |
分析 A.依據鈉鹽都易溶于水解答;
B.氫氧化鈣與碳酸鈉反應生成碳酸鈣沉淀,與碳酸氫鈉反應生成碳酸鈣沉淀和碳酸鈉、水;
C.碳酸氫鈉不穩定,受熱易分解;
D.碳酸鈉與二氧化碳、水反應生成碳酸氫鈉.
解答 解:A.碳酸鈉、碳酸氫鈉都是鈉鹽,都易溶于水,故A錯誤;
B.氫氧化鈣與碳酸鈉、碳酸氫鈉反應都生成碳酸鈣沉淀,現象相同,所以不能用來鑒別二者,故B錯誤;
C.碳酸氫鈉不穩定,受熱易分解生成碳酸鈉和水、二氧化碳,故C正確;
D.碳酸鈉與二氧化碳、水反應生成碳酸氫鈉,所以碳酸鈉可以轉化為碳酸氫鈉,故D錯誤;
故選:C.
點評 本題考查了Na2CO3和NaHCO3性質比較,明確二者的性質是解題關鍵,注意二者之間的轉化,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | Y的最高價氧化物對應水化物的酸性比W的強 | |
| B. | W的氣態氫化物比X的穩定 | |
| C. | 離子半徑的大小順序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | XY2與ZY2中的化學鍵類型相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
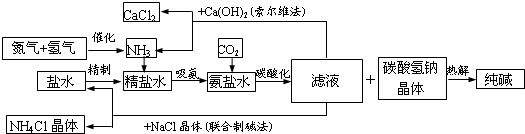
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24LCl2溶于水,轉移的電子數目為0.05NA | |
| B. | 常溫下,1 L0.1mol/L的Na2CO3溶液中含有的CO32-離子數為0.1NA | |
| C. | 標準狀況下,22.4 L CO和NO的混合氣體中所含的氧原子總數為NA | |
| D. | 將含有1mol FeCl3的濃溶液完全水解可得到Fe(OH)3膠粒的數目為 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 一定溫度下,反應MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0 | |
| B. | 用pH均為12的NaOH溶液和氨水分別中和等物質的量的HCl,消耗氨水的v更大 | |
| C. | N2(g)+3H2(g)?2NH3(g) (△H<0),當其他條件不變時,升高溫度,H2的反應速率增大、轉化率減小 | |
| D. | 對于乙酸與乙醇的酯化反應(△H<0),加入少量濃硫酸并加熱,該反應的反應速率和平衡常數均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氧化亞銅(Cu2O)作為一種重要的無機化工原料,在涂料、有色玻璃和催化劑等領域有著廣泛的用途.回答下列問題:
氧化亞銅(Cu2O)作為一種重要的無機化工原料,在涂料、有色玻璃和催化劑等領域有著廣泛的用途.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 現向一密閉容器中充入1molN2和3molH2,在一定條件下使該反應發生,達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等 | |
| B. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.該溶液中加入一定量鹽酸恰好完全反應,將溶液蒸干后,所得固體質量無法計算 | |
| C. | 將54.4g鐵粉和氧化鐵的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反應,放出氫氣4.48L.反應后的溶液中滴加KSCN不顯紅色,且無固體剩余物,反應后得到FeSO4的物質的量是0.8mol | |
| D. |  某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等離子,當向該溶液中加入某濃度的NaOH溶液時,發現生成沉淀的物質的量隨NaOH溶液的體積變化如圖所示,由此可知,該溶液中肯定含有的陽離子是H+、NH4+、Mg2+、Al3+ 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等離子,當向該溶液中加入某濃度的NaOH溶液時,發現生成沉淀的物質的量隨NaOH溶液的體積變化如圖所示,由此可知,該溶液中肯定含有的陽離子是H+、NH4+、Mg2+、Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 將等濃度的CH3COOH和HClO溶液,pH小的是HClO | |
| B. | Na2CO3和NaHCO3溶液中粒子種類不同 | |
| C. | 溶液水的電離程度①>②>④>③ | |
| D. | NaHCO3溶液中,c(Na +)=c(CO3 2-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com