
 氧化亞銅(Cu2O)作為一種重要的無機化工原料,在涂料、有色玻璃和催化劑等領域有著廣泛的用途.回答下列問題:
氧化亞銅(Cu2O)作為一種重要的無機化工原料,在涂料、有色玻璃和催化劑等領域有著廣泛的用途.回答下列問題:分析 (1)根據氧化亞銅的顏色確定添加Cu2O的涂斜或玻璃的顏色即可;
(2)①在電解池的陰極上是溶液中的陽離子發生得電子的還原反應,根據放電順序來回答;
②在堿性環境下,CuCln1-n和氫氧根離子之間發生反應得到轉紅色沉淀,據此書寫離子方程式;
(3)①反應中化合價升高的元素是Fe,化合價降低的元素是Mn,根據電子守恒來配平方程式即可;
②高錳酸鉀具有強氧化性,據此選擇滴定管;
③根據發生的反應找到Cu2O和KMnO4之間的關系式,進行相應的計算即可.
解答 解:(1)氧化亞銅的顏色是磚紅色,所以添加Cu2O的涂斜或玻璃顯磚紅色,故答案為:磚紅;
(2)①在電解池的陰極上是溶液中的陽離子發生得電子的還原反應,根據放電順序,發生的反應為:2H++2e-=H2↑,故答案為:2H++2e-=H2↑;
②在堿性環境下,CuCln1-n和氫氧根離子之間發生反應得到轉紅色沉淀,離子方程式CuCln1-n+2OH-=Cu2O↓+
H2O+2nCl-,
故答案為:CuCln1-n+2OH-=Cu2O↓+H2O+2nCl-;
(3)①反應FeSO4+KMnO4+H2SO4→Fe2(SO4)3+MnSO4+K2SO4+H20中化合價升高的元素是Fe,共升高2價,化合價降低的元素是Mn,降低5價,根據電子守恒,含錳元素的物質前邊系數是2,鐵原子數是10,硫酸亞鐵前邊是10,硫酸鐵前邊是5,根據元素守恒,配平其他物質,結果為:10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,故答案為:10;2;8;5;2;1;8;
②高錳酸鉀具有強氧化性,應該選擇酸式滴定管,故答案為:酸式;
③根據發生的反應Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O、10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,找到Cu2O和KMnO4之間的關系為:Cu2O~$\frac{2}{5}$KMnO4,產品質量為1.0g,滴定時消耗0.10mol•L-1的KMnO4標準溶液20.00mL,則產品中Cu2O的物質的量是$\frac{0.1×0.02}{0.4}$mol=0.005mol,質量分數是$\frac{0.005mol×100g/mol}{1.0g}$×100%=72%.故答案為:72%.
點評 本題綜合考查學生電解原理的應用、電極反應式的書寫、氧化還原反應的配平以及物質含量的測定等知識,屬于綜合知識的考查,難度大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:選擇題
| A. | SO2溶于水和H2SO3分解 | |
| B. | H2跟I2化合成HI和HI分解 | |
| C. | SO2跟O2化合成SO3和SO3分解 | |
| D. | NH3與HCl化合生成NH4Cl和NH4Cl受熱分解生成NH3和HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原反應中得失電子總數一定相等 | |
| B. | 有單質參加的反應一定是氧化還原反應 | |
| C. | 電解質溶液中陰陽離子的總數一定相等 | |
| D. | 分解反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
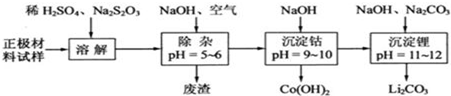
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3可溶,NaHCO3難溶 | |
| B. | 可用Ca(OH)2溶液鑒別Na2CO3和NaHCO3兩種溶液 | |
| C. | Na2CO3中的NaHCO3可通過加熱的方法除去 | |
| D. | Na2CO3不能轉化成與NaHCO3,而NaHCO3能轉化為Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室通常用如右圖所示的裝置來制取氨氣.回答下列問題:
實驗室通常用如右圖所示的裝置來制取氨氣.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子半徑:A2->D->B+ | |
| B. | 元素B、C的最高價氧化物對應水化物的堿性:B>C | |
| C. | 簡單氫化物的穩定性:A>D | |
| D. | A與B形成的化合物中可能既有離子鍵又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com