
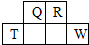
 短周期元素Q、R、T、W在元素周期表中的位置如圖所示,其中T的單質既可與鹽酸反應,又可與NaOH溶液反應,請回答下列問題:
短周期元素Q、R、T、W在元素周期表中的位置如圖所示,其中T的單質既可與鹽酸反應,又可與NaOH溶液反應,請回答下列問題: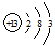 .
.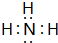
分析 由短周期元素Q、R、T、W在元素周期表中的位置可知,Q、R處于第二周期,T、W處于第三周期,T的單質既可與鹽酸反應,又可與NaOH溶液反應,則T是Al,可推知Q是C,R是N,W是S.
(1)T為Al,原子核外有13個電子,有3個電子層,各層電子數為2、8、3;
(2)同周期自左而右元素非金屬性增強;
(3)氫氧化鋁是兩性氫氧化物,能溶于氫氧化鈉溶液中;
(4)R與氫形成的氫化物為NH3;
(5)同周期自左向右原子半徑逐漸減小,一般電子層越多原子半徑越大.
解答 解:由短周期元素Q、R、T、W在元素周期表中的位置可知,Q、R處于第二周期,T、W處于第三周期,T的單質既可與鹽酸反應,又可與NaOH溶液反應,則T是Al,可推知Q是C,R是N,W是S.
(1)T為Al,原子核外有13個電子,原子結構示意圖為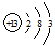
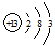
(2)同周期自左向右非金屬性逐漸增強,所以碳的非金屬性弱于氮的,故答案為:弱于;
(3)氫氧化鋁是兩性氫氧化物,能溶于氫氧化鈉溶液中,反應離子方程式為Al3++4OH-=AlO2-+2H2O,故答案為:Al3++4OH-=AlO2-+2H2O;
(4)R與氫形成的氫化物為NH3,氨氣的電子式為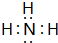 ,故答案為:
,故答案為: ;
;
(5)同周期自左向右原子半徑逐漸減小,一般電子層越多原子半徑越大,所以原子半徑大小順序為:T>W>Q>R,故答案為:T>W>Q>R.
點評 本題考查元素周期表的結構和元素周期律的應用,推斷元素是解題關鍵,旨在考查學生對基礎知識的鞏固.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純凈物都是由同種分子構成 | |
| B. | 純凈物可能是單質,也可能是化合物 | |
| C. | 礦泉水是純凈物 | |
| D. | 純凈物就是由同種元素組成的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
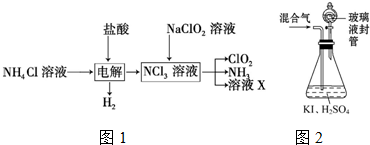
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com