
 .如果A、B均由三種元素組成,B為兩性不溶物,則由A與過量的C反應轉化為B的離子方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三種元素組成,B為兩性不溶物,則由A與過量的C反應轉化為B的離子方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.分析 (1)X、Y、Z、Q、R是五種短周期元素,原子序數依次增大.X是原子半徑最小的主族元素,則X為H元素;Z、R分別是地殼中含量最高的非金屬元素和金屬元素,則Z為O元素、R為Al;Y元素最高正價與最低負價之和為0,由原子序數可知,只能處于第ⅣA族,而其原子序數又小于O元素,故Y為碳元素;Q與X同主族,結合原子序數可知Q為Na;
(2)①計算生成2mol氨氣放出的熱量,注明物質的聚集狀態與反應熱書寫熱化學方程式;
②反應熱=反應物總鍵能-生成物總鍵能;
(3)原電池負極發生氧化反應,氨氣在負極失去電子,堿性條件下生成氮氣與水.
解答 解:(1)X、Y、Z、Q、R是五種短周期元素,原子序數依次增大.X是原子半徑最小的主族元素,則X為H元素;Z、R分別是地殼中含量最高的非金屬元素和金屬元素,則Z為O元素、R為Al;Y元素最高正價與最低負價之和為0,由原子序數可知,只能處于第ⅣA族,而其原子序數又小于O元素,故Y為碳元素;Q與X同主族,結合原子序數可知Q為Na;
①所有元素中H原子半徑最小,同周期自左而右原子半徑減小、非金屬增強,同主族自上而下原子半徑增大、非金屬性減弱,故上述五種元素中,Na的原子半徑最大,O的非金屬性最強,
故答案為:Na;O;
②H與C能形成多種化合物,其中既含極性鍵又含非極性鍵,且相對分子質量最小的物質為C2H2,
故答案為:C2H2;
③由以上某些元素組成的化合物A、B、C、D有如下轉化關系:A$?_{D}^{C}$B(在水溶液中進行),其中C是溶于水顯酸性的氣體,則C為CO2,D是淡黃色固體則D為Na2O2,Na2O2的電子式為 ;
;
如果A、B均由三種元素組成,B為兩性化合物,且不溶于水,則B為Al(OH)3,A為NaAlO2,甲與過量的CO2反應生成生成氫氧化鋁沉淀與碳酸氫鈉,反應離子方程式為:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案為: ;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)①生成2mol氨氣放出的熱量為46.1kJ×2=92.2kJ,反應熱化學方程式為:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,
故答案為:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
②設斷開1mol N-H鍵所需的能量是xkJ,則945.8kJ/mol+3×436.0kJ/mol-6×xkJ/mol=-92.2kJ/mol,解得x=391,
故答案為:391;
(3)原電池負極發生氧化反應,氨氣在負極失去電子,堿性條件下生成氮氣與水,負極電極反應式為:2NH3+6OH--6e-=N2+6H2O,
故答案為:2NH3+6OH--6e-=N2+6H2O.
點評 本題考查結構性質位置關系應用、熱化學方程式書寫、鍵能與反應熱關系、原電池等,推斷元素是解題的關鍵,注意元素最高正價與最低負價之和均為0,可以為ⅣA族元素,也可以為H元素,中學中較少涉及H元素的負化合價.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
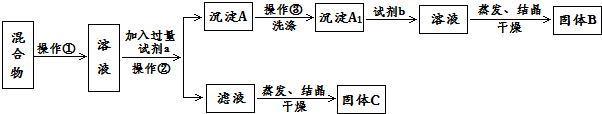
 .
. .同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基.
.同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基. (任寫一種).
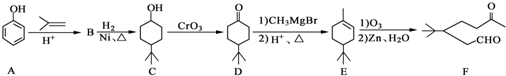
(任寫一種).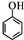 )和CH2=CH2為原料制備有機物
)和CH2=CH2為原料制備有機物  的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 35g | B. | 30g | C. | 20g | D. | 15g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
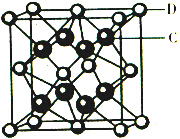 已知A、B、C、D、E都是元素周期表中前36號的元素,它們的原子序數依次增大.A原子基態時最外層電子數是其內層電子總數的2倍,B原子基態時s電子數與P電子數相等,C在元素周期表的各元素中電負性最大,D的基態原子核外有6個能級且全部充滿電子,E原子基態時未成對電子數是同周期元素中最多的.F原子核外最外層電子數與Na相同,其余各層電子均充滿.
已知A、B、C、D、E都是元素周期表中前36號的元素,它們的原子序數依次增大.A原子基態時最外層電子數是其內層電子總數的2倍,B原子基態時s電子數與P電子數相等,C在元素周期表的各元素中電負性最大,D的基態原子核外有6個能級且全部充滿電子,E原子基態時未成對電子數是同周期元素中最多的.F原子核外最外層電子數與Na相同,其余各層電子均充滿.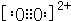 ,1mol B22+中含有的π鍵數目為2NA.
,1mol B22+中含有的π鍵數目為2NA. 該離子化合物晶體的密度為a g/cm3,則晶胞的體積是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德羅常數的值為NA).
該離子化合物晶體的密度為a g/cm3,則晶胞的體積是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德羅常數的值為NA).查看答案和解析>>
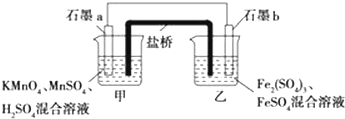
科目:高中化學 來源: 題型:選擇題

| A. | 原電池的總反應為Fe+Cu2+═Fe2++Cu | |
| B. | 鹽橋中是KNO3溶液,則鹽橋中NO3-移向乙燒杯 | |
| C. | 其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為2H++2e-═H2↑ | |
| D. | 反應前,電極質量相等,一段時間后,兩電極質量相差12g,導線中通過0.2mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com