
 葡萄酒常用Na2S2O5做抗氧化劑.
葡萄酒常用Na2S2O5做抗氧化劑. 分析 (1)在Na2S2O5與O2的反應中,硫從+4價升為+6價,氧從0價降為-2價,根據電子得失守恒進行計算;
(2)根據圖可知,pH=4.5時,溶液中主要以亞硫酸氫根離子形式存在,據此書寫水解方程式;當溶液pH小于1后,溶液中主要以亞硫酸形成存在,但亞硫酸不穩定,易分解生成二氧化硫,根據Ksp[BaSO4]=c(Ba2+)•c(SO42-),可計算出需要放熱c(Ba2+),進而計算最大濃度c(SO32-),據此答題;
(3)根據反應SO2+I2+2H2O=H2SO4+2HI,由碘的物質的量可計算出二氧化硫的物質的量,根據硫元素守恒再換算成Na2S2O5,由此計算葡萄酒樣品中抗氧化劑的殘留量.
解答 解:(1)在Na2S2O5與O2的反應中,硫從+4價升為+6價,氧從0價降為-2價,1.90g Na2S2O5的物質的量為0.01mol,根據電子得失守恒可知能還原氧氣的物質的量為0.01mol,即標準狀況224mL,
故答案為:224;
(2)根據圖可知,pH=4.5時,溶液中主要以亞硫酸氫根離子形式存在,所以水解方程式為Na2S2O5+H2O=2NaHSO3,當溶液pH小于1后,溶液中主要以亞硫酸形成存在,但亞硫酸不穩定,易分解生成二氧化硫或亞硫酸被氧化也會導致濃度小,
根據Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{O}_{4}^{2-})}$=$\frac{1×1{0}^{-10}}{1×1{0}^{-5}}$=10-5mol•L-1,則溶液中SO32-的最大濃度c(SO32-)=$\frac{Ksp(BaS{O}_{3})}{c(B{a}^{2+})}$=$\frac{5×1{0}^{-7}}{1{0}^{-5}}$=0.05mol•L-1,
故答案為:Na2S2O5+H2O=2NaHSO3;亞硫酸不穩定,易分解生成二氧化硫,或亞硫酸被氧化;0.05;
(3)根據題意可知,消耗標準I2溶液的體積為$\frac{15.98mL+16.02mL}{2}$=16.0mL,所以I2的物質的量為16.0×10-3L×0.0225mol•L-1=3.6×10-4mol,根據反應SO2+I2+2H2O=H2SO4+2HI,可知二氧化硫的物質的量為3.6×10-4mol,SO2的質量為64g/mol×3.6×10-4mol=23.04mg,所以葡萄酒樣品中抗氧化劑的殘留量為$\frac{23.04mg}{0.1L}$=230.4mg•L-1,答:殘留量為230.4mg•L-1.
點評 本題考查圖象分析、物質含量的測定、氧化還原反應滴定等,難度中等,明確實驗原理是解本題關鍵,根據物質的性質分析解答,注意元素化合物知識的積累和靈活運用.


 一線名師提優試卷系列答案
一線名師提優試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2O、Na2O2都是鈉的氧化物,都是堿性氧化物 | |
| B. | Na2O、Na2O2都是易溶于水(與水反應)的白色固體 | |
| C. | Na2O2在和CO2的反應中既是氧化劑又是還原劑 | |
| D. | Na2O2與水反應時,1mol Na2O2轉移2 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
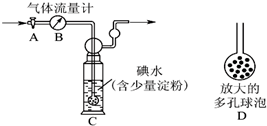 氮氧化物和SO2是造成霧霾天氣的主要原因之一.
氮氧化物和SO2是造成霧霾天氣的主要原因之一.| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
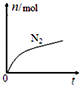
| A. | 該反應的還原劑是Cl- | |
| B. | 消耗1 mol還原劑,轉移6 mol電子 | |
| C. | 氧化劑與還原劑的物質的量之比為2:3 | |
| D. | 反應后溶液的酸性明顯增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2溶于水,其水溶液能導電,說明SO2是電解質 | |
| B. | 向氨水中加入氫氧化鈉或氯化銨都能使氨水的電離平衡逆向移動,一水合氨的電離常數減小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室溫下,將濃度為0.1 mol•L-1HF溶液加水稀釋,其電離平衡常數和$\frac{c({H}^{+})}{c(HF)}$均不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
| 化學式 | 電離平衡常數(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2可用作呼吸面具中的供氧劑 | |
| B. | 在常溫下可用鋁制容器貯藏運輸濃硫酸 | |
| C. | Al(OH)3可作治療胃酸過多的一種藥劑 | |
| D. | 四氧化三鐵俗稱鐵紅,可用于作油漆、紅色涂料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
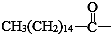 后,苦味消失,成為便于口服的無味氯霉素.以下關于無味氯霉素的敘述中正確的( )
后,苦味消失,成為便于口服的無味氯霉素.以下關于無味氯霉素的敘述中正確的( )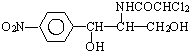
| A. | 無味氯霉素的分子式為:C27H44O6N2Cl2 | |
| B. | 它的水溶性變差,所以苦味消失 | |
| C. | 它是棕櫚酸的鹽類 | |
| D. | 它的水溶性變良,所以苦味消失 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com