
| A. | SO2溶于水,其水溶液能導電,說明SO2是電解質 | |
| B. | 向氨水中加入氫氧化鈉或氯化銨都能使氨水的電離平衡逆向移動,一水合氨的電離常數減小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室溫下,將濃度為0.1 mol•L-1HF溶液加水稀釋,其電離平衡常數和$\frac{c({H}^{+})}{c(HF)}$均不變 |
分析 A.在水溶液中或熔融狀態下自身電離出離子導電的化合物為電解質;
B.電離常數只與溫度有關;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,會和溶液中的鹽酸反應;
D.HF屬于弱電解質,加水不斷稀釋時,電離程度增大,但是電離平衡常數不變.
解答 解:A.在水溶液中或熔融狀態下自身電離出離子導電的化合物為電解質,二氧化硫溶于水和水反應生成亞硫酸是電解質導電,二氧化硫是非電解質,故A錯誤;
B.向氨水中加入氫氧化鈉或氯化銨都能使氨水的電離平衡逆向移動,但是電離常數只與溫度有關,所以一水合氨的電離常數不變,故B錯誤;
C.氯水中存在:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,會和溶液中的鹽酸反應,則平衡向正方向移動,所以溶液中c(HClO)增大,故C正確;
D.因為因Ka(HF)=$\frac{c({H}^{+})×c({F}^{-})}{c(HF)}$,當HF溶液加水不斷稀釋,促進電離,c(F-)不斷減小,溫度不變,Ka(HF)不變,所以$\frac{c({H}^{+})}{c(HF)}$增大,故D錯誤.
故選C.
點評 本題考查了電解質的概念、平衡的移動、電離常數的影響因素和計算,題目綜合性強,難度中等,D選項為易錯項,注意判斷離子濃度變化時,可以借助于平衡常數表達式,運用整體法判斷.


 孟建平錯題本系列答案
孟建平錯題本系列答案 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 上述反應既屬于氧化還原反應,又屬于離子反應 | |
| B. | 生成1 mol Cl2轉移電子數均為2NA | |
| C. | 鹽酸濃度越大,Cl-的還原性越強 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 溶液中水電離出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 與0.05 mol•L-1 NaOH溶液等體積混合,水的電離平衡向正向移動 | |
| D. | 上述溶液中加入一定量NaA晶體或加水稀釋,溶液的c(OH-)均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(濃)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 葡萄酒常用Na2S2O5做抗氧化劑.
葡萄酒常用Na2S2O5做抗氧化劑. 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
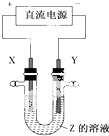 利用如圖所示裝置,當X、Y選用不同材料時,可將電解原理廣泛應用于工業生產.下列說法中正確的是( )
利用如圖所示裝置,當X、Y選用不同材料時,可將電解原理廣泛應用于工業生產.下列說法中正確的是( )| A. | 外加電流的陰極保護法中,Y是待保護金屬 | |
| B. | 銅的精煉中,X是純銅,Y是粗銅,Z是CuSO4 | |
| C. | 電鍍工業中,X是待鍍金屬,Y是鍍層金屬 | |
| D. | 氯堿工業中,X、Y均為石墨,X附近能得到氫氧化鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:NaHCO3<Na2CO3 | |
| B. | 不可用氫氧化鈣鑒別兩者 | |
| C. | 兩溶液堿性相同時的濃度:Na2CO3>NaHCO3 | |
| D. | 與同濃度的硫酸溶液反應放出氣泡的快慢程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
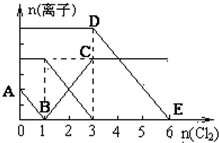 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.橫、縱坐標的單位均為mol.有關說法不正確的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.橫、縱坐標的單位均為mol.有關說法不正確的是( )| A. | 線段BC代表Fe3+物質的量的變化情況 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 當通入Cl22mol時,溶液中已發生的反應可表示為2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH+HCl與KOH+CH3COOH | B. | NaOH+H2SO4與 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4與Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 與Na2CO3+HCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com