
| A. | 常溫下,100 mL 1 mol•L-1 Na2CO3溶液中含有的陰離子數大于0.1NA | |
| B. | 常溫常壓下,28g14CO和N2的混合物所含的質子數為14NA | |
| C. | 將NA個NH3分子溶于1L水中得到1 mol•L-1的氨水 | |
| D. | 1molCl2分別與足量的鐵或氫氧化鈉溶液反應,轉移電子數均為2NA |
分析 A.碳酸根離子水解生成碳酸氫根離子與氫氧根離子;
B.14CO和N2的摩爾質量分別為30g/mol和28g/mol;
C.物質的量濃度中體積為溶液的體積;
D.氯氣與鐵反應生成生成氯化鐵,氯氣全部被還原;氯氣與氫氧化鈉反應為歧化反應.
解答 解:A.碳酸根 離子水解生成碳酸氫根離子與氫氧根離子,常溫下,100 mL 1 mol•L-1 Na2CO3溶液中含有的陰離子數大于0.1NA,故A正確;
B.14CO和N2的摩爾質量分別為30g/mol和28g/mol,故混合氣體的平均摩爾質量大于28g/mol,則28g混合物的物質的量小于1mol,則含有的質子數小于14NA個,故B錯誤;
C.將NA個NH3分子溶于1L水中得到溶液的體積不是1L,所以得到溶液的物質的量濃度不是1 mol•L-1,故C錯誤;
D.氯氣與鐵反應生成生成氯化鐵,氯氣全部被還原;氯氣與氫氧化鈉反應為歧化反應,所以:1molCl2分別與足量的鐵反應轉移電子數為2NA,與氫氧化鈉溶液反應,轉移電子數均為NA,故D錯誤;
故選:A.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,注意鹽類水解的性質,注意物質的量濃度中體積的含義,題目難度不大.


 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:解答題
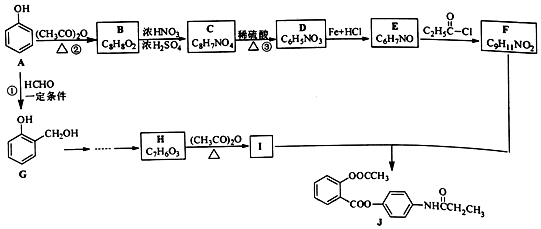
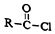 +R′-NH2→
+R′-NH2→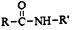 +HCl
+HCl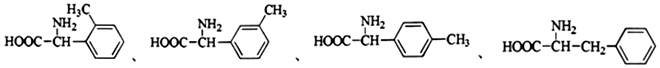 .
.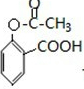 ;合成過程中設計步驟②和③的目的是保護酚羥基不被氧;
;合成過程中設計步驟②和③的目的是保護酚羥基不被氧;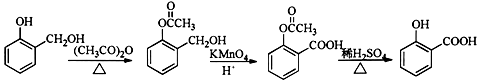 .
.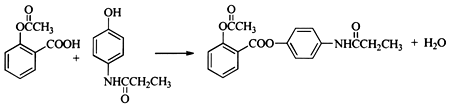 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵與鹽酸反應,鐵合金不與鹽酸反應 | |
| B. | 一定條件下,鐵粉可與水蒸氣反應生成四氧化三鐵和氫氣 | |
| C. | 不銹鋼是鐵合金,只含金屬元素 | |
| D. | 純鐵的硬度和熔點均低于鐵合金 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2和S8的混合物共6.4 g,所含硫原子數一定為0.2NA | |
| B. | 將100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒數目為0.01NA | |
| C. | 在反應KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2,轉移的電子數為6NA | |
| D. | 將含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,產生氣體的分子數目為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2、SiO2的晶體結構類型不同 | |
| B. | 加熱硅、硫晶體使之熔化,克服的作用力不同 | |
| C. | HF比HCl穩定是因為HF間存在氫鍵 | |
| D. | NaOH、NH4Cl晶體中既有離子鍵又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 800:108 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的焓變為負值 | |
| B. | 升高溫度,正反應速率增大,逆反應速率減小,平衡正向移動 | |
| C. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g) 的平衡常數K1=K2 | |
| D. | 若恒容、恒溫下充入CO,則K值變大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com