
| 操 作 | 現 象 |
通入氯氣至過量 | I.A中溶液變紅 II.稍后,溶液由紅色變為黃色 |
 .
.分析 (1)B裝置是用來吸收氯氣尾氣的,根據元素守恒和電荷守恒可以寫出離子方程式;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+與SCN-反應生成紅色的硫氰化鐵溶液,呈紅色,據此答題;
(3)①A中黃色溶液于試管中,加入NaOH溶液,有紅褐色沉淀生成,應當是氫氧化鐵固體,所以原溶液中應當有Fe3+,據此答題;
(4)①根據SCN-的電子式為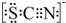 可知,SCN-中碳顯+4價,硫顯-2價,氮顯-3價,碳已經是最高正價了,不能再被氧化了,據此答題;
可知,SCN-中碳顯+4價,硫顯-2價,氮顯-3價,碳已經是最高正價了,不能再被氧化了,據此答題;
②加入用鹽酸酸化的BaCl2溶液,產生白色沉淀,說明白色沉淀為硫酸鋇,即溶液中有硫酸根離子,其中硫顯+6價,而原來SCN-中硫顯-2價,所以被氧化的元素為硫元素,據此答題;
③利用硝酸根離子在酸性條件下有強氧化性,遇到銅被還原,生成一氧化氮,在空氣中被 氧化成紅棕色的二氧化氮氣體,可以檢驗硝酸根離子的存在,據此答題;
④SCN-與Cl2反應的化學方程式可以計算出電子轉移的物質的量.
解答 解:(1)B裝置是用來吸收氯氣尾氣的,根據元素守恒和電荷守恒可以寫出離子方程式為:Cl2+2OH-═Cl-+ClO-+H2O,
故答案為:Cl2+2OH-═Cl-+ClO-+H2O;
(2)氯氣具有強氧化性,則Fe2+被Cl2氧化生成Fe3+,Fe3+與SCN-反應生成紅色的硫氰化鐵溶液,呈紅色,
故答案為:Fe2+被Cl2氧化生成Fe3+,Fe3+與SCN-反應生成紅色的硫氰化鉀,所以溶液變紅;
(3)①A中黃色溶液于試管中,加入NaOH溶液,有紅褐色沉淀生成,應當是氫氧化鐵固體,所以原溶液中應當有Fe3+,
故答案為:Fe3+;
(4)①根據SCN-的電子式為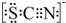 可知,SCN-中碳顯+4價,硫顯-2價,氮顯-3價,碳已經是最高正價了,不能再被氧化了,
可知,SCN-中碳顯+4價,硫顯-2價,氮顯-3價,碳已經是最高正價了,不能再被氧化了,
故答案為:SCN-中的碳元素是最高價態+4價;
②加入用鹽酸酸化的BaCl2溶液,產生白色沉淀,說明白色沉淀為硫酸鋇,即溶液中有硫酸根離子,其中硫顯+6價,而原來SCN-中硫顯-2價,所以被氧化的元素為硫元素,
故答案為:硫元素;
③利用硝酸根離子在酸性條件下有強氧化性,遇到銅被還原,生成一氧化氮,在空氣中被 氧化成紅棕色的二氧化氮氣體,可以檢驗硝酸根離子的存在,據此可知實驗方案為:取足量銅粉于試管中,加入A中黃色溶液和一定量的稀鹽酸,加熱,觀察到試管上方有紅棕色氣體生成,證明A中存在,SCN-中氮元素被氧化成,
故答案為:取足量銅粉于試管中,加入A中黃色溶液和一定量的稀鹽酸,加熱,觀察到試管上方有紅棕色氣體生成,證明A中存在,SCN-中氮元素被氧化成;
④SCN-與Cl2反應生成硫酸根和硝酸根還有二氧化碳,所以它們反應的化學方程式為:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,該反應中電子轉移數目為16,則由方程式可知,每生成1mol二氧化碳要轉移16mol電子,
故答案為:16.
點評 本題是實驗方案的設計與評價,題目難度中等,試題綜合性較強,涉及到了離子的檢驗、氧化還原的離子方程式的書寫、實驗步驟的設計、化學計算等知識點,熟練掌握元素化合物的基礎知識及實驗基本操作要求為解答關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 主族序數等于原子最外層電子數 | |
| B. | 主族元素最高正化合價等于最外層電子數 | |
| C. | 第n主族元素其最高正化合價為+n價,最低負化合價絕對值為8-n(n≥4) | |
| D. | 第n主族元素其最高價氧化物分子式為R2On,氫化物分子式為RHn(n≥4) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| Z | W |
| A. | 氣態氫化物的熱穩定性:X<Y | |
| B. | 最高價氧化物對應水化物的酸性:W>Z>X | |
| C. | X、Y、Z元素均存在同素異形體 | |
| D. | W的單質具有漂白性,能使干燥的有色布條褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸氫鈉的水解反應:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入鹽酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入熱的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚鈉溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1molMg2+含有NA個電子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA個Na+ | |
| C. | 2molCu與足量S加熱充分反應,轉移2NA個電子 | |
| D. | 4gCH4與Cl2在光照條件下反應全部轉化為CCl4時,斷裂NA個C-H鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com