
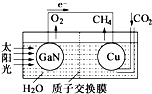
 人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.科學家用氮化鎵材料與銅組裝如圖的人工光合系統,成功地實現了以CO2和H2O合成CH4,下列說法不正確的是( )
人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.科學家用氮化鎵材料與銅組裝如圖的人工光合系統,成功地實現了以CO2和H2O合成CH4,下列說法不正確的是( )| A. | 該過程是將太陽能轉化為化學能的過程 | |
| B. | GaN表面發生氧化反應,有O2產生 | |
| C. | 電解液中的H+從質子交換膜右側向左側遷移 | |
| D. | Cu表面的電極反應式 CO2+8e-+8H+═CH4+2H2O |
分析 該裝置中,根據電子流向知,GaN是負極、Cu是正極,負極反應式為:2H2O-4e-=4H++O2↑,正極反應式為:CO2+8e-+8H+=CH4+2H2O,電解質溶液中陽離子向正極移動,據此分析解答.
解答 解:A.根據圖示可知,該裝置中將太陽能轉化為化學能的過程,故A正確;
B.根據圖示可知,GaN表面有氧氣生成,發生反應為2H2O-4e-=4H++O2↑,所以GaN表面發生氧化反應,故B正確;
C.放電時,電解質溶液中陽離子向正極移動,所以裝置中的H+由左向右移動,故C錯誤;
D.根據電子流向知,Cu是正極,正極上二氧化碳得電子和氫離子反應生成甲烷,電極反應式為:CO2+8e-+8H+=CH4+2H2O,故D正確;
故選C.
點評 本題考查化學電源新型電池,題目難度中等,明確原電池原理為解答根據,注意正確判斷電極反應、電子流向、離子流向,難點是電極反應式的書寫.


 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源: 題型:選擇題
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡向正反應方向移動 | B. | a+b>c+d | ||
| C. | C的體積分數降低 | D. | B的轉化率升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
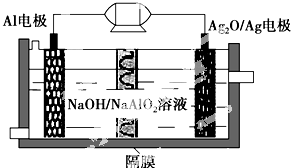 Al-Ag2O電池是一種可用作水下動力的優良電源,其原理如圖所示.該電池工作時總反應式為2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,則下列說法錯誤的是( )
Al-Ag2O電池是一種可用作水下動力的優良電源,其原理如圖所示.該電池工作時總反應式為2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,則下列說法錯誤的是( )| A. | 工作時正極發生還原反應 | |
| B. | 當電極上生成1.08 g Ag時,電路中轉移的電子為0.01 mol | |
| C. | Al電極的反應式為Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作時電解液中的Na+透過隔膜移向Al電極放電充電 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 加入試劑 | 離子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反應類型是加聚反應.
,反應類型是加聚反應.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
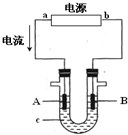 電解原理在化學工業中有廣泛應用.右圖表示一個電解池,裝有電解液c;A、B是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.右圖表示一個電解池,裝有電解液c;A、B是兩塊電極板,通過導線與直流電源相連.請回答以下問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com