
分析 (1)依據平衡常數概念寫出表達式;因反應是放熱反應,升溫,平衡逆向進行,平衡常數減小;
(2)改變條件增大反應速率,可以采取加入催化劑、升溫、加壓、增大濃度等措施,且提高CO的轉化率應使平衡向正反應方向移動,結合平衡移動原理分析解答;
(3)①在一定溫度下,在容積為1L的密閉容器中充入3mol H2、3mol CO,發生反應:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在10min時剛好達到平衡,此時測得H2的物質的量濃度為1.5mo1•L-1.物質的量1.5mo1•L-1×1L=1.5mol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)
起始量(mol) 3 3 0 0
變化量(mol) 1.5 1.5 0.5 0.5
平衡量(mol) 1.5 1.5 0.5 0.5
轉化率=$\frac{消耗量}{起始量}$×100%;
②依據①計算平衡常數,計算此時的濃度商和平衡常數比較大小判斷反應進行的方向;
③根據化學平衡狀態的特征解答,當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態.
解答 解:(1)該反應的平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}({H}_{2}){c}^{3}(CO)}$,因反應是放熱反應,升溫,平衡逆向進行,平衡常數減小,故答案為:$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}({H}_{2}){c}^{3}(CO)}$;變小;
(2)a.正反應為放熱反應,降低溫度,平衡向正反應方向移動,CO的轉化率增大,但反應速率減小,故a錯誤;
b.加入催化劑,反應速率增大,不影響平衡移動,CO的轉化率不變,故b錯誤;
c.正反應為氣體體積減小的反應,縮小容器體積,壓強增大,反應速率增大,平衡向正反應方向移動,CO的轉化率增大,故c正確;
d.增加H2的濃度,反應速率增大,平衡向正反應移動,CO的轉化率增大,故d正確;
e.增加CO的濃度,反應速率增大,平衡向正反應移動,但CO的轉化率減小,故e錯誤;
故答案為:cd;
(3)①在一定溫度下,在容積為1L的密閉容器中充入3mol H2、3mol CO,發生反應:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在10min時剛好達到平衡,此時測得H2的物質的量濃度為1.5mo1•L-1.物質的量1.5mo1•L-1×1L=1.5mol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)
起始量(mol) 3 3 0 0
變化量(mol) 1.5 1.5 0.5 0.5
平衡量(mol) 1.5 1.5 0.5 0.5
衡時n(CH3OCH3)=0.5mol,
平衡時CO的轉化率=$\frac{1.5mol}{3mol}$×100%=50%,
故答案為:0.5;50%;
②平衡常數K=$\frac{0.5×0.5}{1.{5}^{3}×1.{5}^{3}}$=0.022,達到平衡后,若向容器中再充入1mol H2、1mol CO2,Qc=$\frac{1.5×0.5}{2.{5}^{3}×1.{5}^{3}}$=0.014<K,反應正向進行,v(正)>v(逆),
故答案為:>;
③A.反應速率之比等于化學方程式計量數之比,在任何時候,反應速率v(CO)=3v(CO2),不能證明反應達到平衡狀態,故A錯誤;
B.在任何時候,生成amolCO2的同時消耗3amolH2,說明反應正向進行,不能證明反應達到平衡狀態,故B錯誤;
C.c(CO2)=c(CO),和起始量、變化量有關,不能證明反應達到平衡狀態,故C錯誤;
D.反應前后氣體質量不變,氣體物質的量減小,反應過程中混合氣體的平均相對分子質量不變,說明反應達到平衡狀態,故D正確;
E.體積不變的密閉容器中,氣體質量不變,體積不發生變化,所以氣體的密度始終不變,不能說明反應達到平衡狀態,故E錯誤;
F.密閉容器中氣體質量始終不變,所以氣體的總質量不再改變,不能說明反應達到平衡狀態,故F錯誤;
故答案為:D.
點評 本題考查反應熱計算、化學平衡影響因素、化學平衡計算等,難度中等,注意平衡常數和濃度商比較判斷反應進行方向的方法.


科目:高中化學 來源: 題型:選擇題
| A. | H2O2的氧化性比Fe3+強,其還原性比Fe2+強 | |
| B. | 在該實驗中,最終溶液仍為無色 | |
| C. | 在該實驗中,Fe2+和Fe3+總量保持不變 | |
| D. | H2O2值能的電子,不能失電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發生的化學反應是復分解反應 | |
| B. | 反應的生成物中有Na2CO3 | |
| C. | 反應后形成的混合物的聚集顆粒直徑為1~100nm | |
| D. | 反應說明硅酸易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
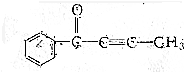 的有機化合物分子中:
的有機化合物分子中:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
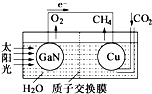 人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.科學家用氮化鎵材料與銅組裝如圖的人工光合系統,成功地實現了以CO2和H2O合成CH4,下列說法不正確的是( )
人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料.科學家用氮化鎵材料與銅組裝如圖的人工光合系統,成功地實現了以CO2和H2O合成CH4,下列說法不正確的是( )| A. | 該過程是將太陽能轉化為化學能的過程 | |
| B. | GaN表面發生氧化反應,有O2產生 | |
| C. | 電解液中的H+從質子交換膜右側向左側遷移 | |
| D. | Cu表面的電極反應式 CO2+8e-+8H+═CH4+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
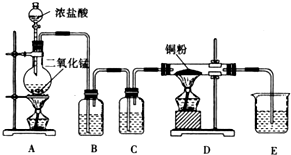 某實驗學習小組用MnO2和濃鹽酸制取純凈干燥的氯氣,并讓氯氣與銅粉反應制取純凈的無水CuCl2,裝置如圖所示.
某實驗學習小組用MnO2和濃鹽酸制取純凈干燥的氯氣,并讓氯氣與銅粉反應制取純凈的無水CuCl2,裝置如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com