
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 ①依據平衡常數隨溫度變化分析溫度對平衡移動的影響,反應自發進行的判斷依據是△H-T△S<0,據此判斷;
②利用三段式計算各自組分物質的量變化量、平衡時的物質的量,依據轉化率概念計算CO的轉化率;根據濃度計算出平衡常數,再判斷溫度.
解答 解:①由表數據可知,溫度升高,平衡常數減小,說明平衡逆向進行,逆向是吸熱反應,正向放熱反應,即△H1<0,CO(g)+2H2(g)?CH3OH(g)反應前后氣體體積減小,熵變△S<0,滿足△H-T△S<0,應在低溫下能自發進行,
故答案為:<,低溫;
②按反應充分反應達到平衡后,測得c(CO)=0.2mol/L,物質的量為0.4mol;
CO (g)+2H2 (g)?CH3OH (g)
起始量(mol) 2 6 0
變化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的轉化率=$\frac{1.6mol}{2mol}$×100%=80%,
故答案為:80%.
點評 本題考查了化學平衡的影響因素和有關計算、反應自發進行的判斷依據等,難度不大,注意掌握平衡計算的應用.


科目:高中化學 來源: 題型:選擇題
| A. | 該合金的熔點介于鈉、鋁之間 | |
| B. | 鈉或鋁形成的氧化物均為堿性氧化物 | |
| C. | 等質量鈉和鋁分別與足量的鹽酸反應鈉產生的氣體多 | |
| D. | 若合金中n(Na)=n(Al),將其投入到足量的水中,可得無色透明溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
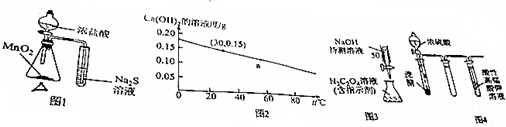
| A. | 圖1的裝置可用于比較MnO2、Cl2、S的氧化性 | |
| B. | 圖2可知:30℃時Ca(OH)2溶液的濃度一定大于60℃時的溫度 | |
| C. | 圖3的裝置可用于已知濃度的H2C2O4溶液測定未知濃度的NaOH溶液 | |
| D. | 圖4的實驗現象:酸性高錳酸鉀溶液中有氣泡出現,且溶液顏色逐漸變淺乃至褪去 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

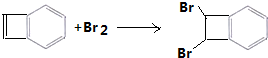
 +2CH3CH2OH$?_{△}^{濃硫酸}$
+2CH3CH2OH$?_{△}^{濃硫酸}$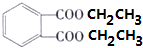 +2H2O
+2H2O查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡向正反應方向移動 | B. | a+b>c+d | ||
| C. | C的體積分數降低 | D. | B的轉化率升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
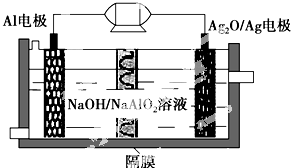 Al-Ag2O電池是一種可用作水下動力的優良電源,其原理如圖所示.該電池工作時總反應式為2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,則下列說法錯誤的是( )
Al-Ag2O電池是一種可用作水下動力的優良電源,其原理如圖所示.該電池工作時總反應式為2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,則下列說法錯誤的是( )| A. | 工作時正極發生還原反應 | |
| B. | 當電極上生成1.08 g Ag時,電路中轉移的電子為0.01 mol | |
| C. | Al電極的反應式為Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作時電解液中的Na+透過隔膜移向Al電極放電充電 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
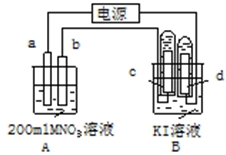 如圖裝置中:b電極用金屬M制成,a、c、d為石墨電極,接通電源,金屬M沉積于b極,同時a、d電極上產生氣泡.試回答
如圖裝置中:b電極用金屬M制成,a、c、d為石墨電極,接通電源,金屬M沉積于b極,同時a、d電極上產生氣泡.試回答查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com