
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 開始沉淀時pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀時pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 |
分析 (1)滴加H2O2能將亞鐵離子氧化為三價鐵離子便于除去,且不引入雜質,據此書寫方程式;
(2)滴加H2O2溶液,稍加熱,目的是氧化亞鐵離子為三價鐵離子便于除去,且不引入雜質,待反應完全后,慢慢加入CuO粉末,攪拌,以控制溶液pH=4,根據題給離子沉淀的PH范圍可知,目的是讓三價鐵離子完全沉淀,銅離子不沉淀;
(3)亞鐵離子和鐵氰化鉀溶液反應生成藍色沉淀;
(4)操作I中用稀硫酸溶解,所以CuO與酸反應,促進三價鐵反發生水解反應生成氫氧化鐵沉淀;
(5)為了抑制Cu2+在加熱過程中水解,Ⅳ中“濾液用稀硫酸酸化;
(6)由硫酸銅溶液獲得硫酸銅晶體的方法為蒸發濃縮、冷卻結晶、過濾、洗滌、干燥.
解答 解:(1)滴加H2O2能將亞鐵離子氧化為三價鐵離子便于除去,過氧化氫為氧化劑,二價鐵為還原劑,所以反應為2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)除去亞鐵離子得到純凈的硫酸銅溶液,根據沉淀PH范圍可知,應先把亞鐵離子轉化為三價鐵離子,再控制PH,開始沉淀pH2.7,完全沉淀pH3.7,使之完全沉淀,所以滴加H2O2溶液目的是氧化亞鐵離子為三價鐵離子,再慢慢加入CuO粉末,攪拌,以控制溶液pH=4,目的是在pH=4時銅離子不沉淀,三價鐵離子沉淀完全,
故答案為:在調節在pH=4時,只將Fe3+轉化為沉淀除去,而不會使Cu2+轉化為沉淀;
(3)亞鐵離子和鐵氰化鉀溶液反應生成藍色沉淀,這是亞鐵離子的特征反應,驗證Ⅱ中Fe2+是否轉化完全的現象是滴加K3[Fe(CN)6]若有藍色沉淀生說,說明Fe2+沒有完全轉化;若沒有藍色沉淀生成,說明Fe2+已經完全轉化,
故答案為:若有藍色沉淀生說,說明Fe2+沒有完全轉化;若沒有藍色沉淀生成,說明Fe2+已經完全轉化;
(4)操作I中加硫酸,向II的溶液中加入CuO粉末至pH為4,CuO和酸反應CuO+2H+=Cu2++H2O,促進三價鐵離子水解,所以總反應為2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+,故答案為:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+;
(5)銅離子水解溶液呈酸性,加酸能抑制銅離子水解,所以Ⅳ中“濾液用稀硫酸酸化”目的抑制Cu2+在加熱過程中水解,以獲得純凈的硫酸銅晶體,
故答案為:用稀硫酸酸化至PH=1,可以抑制Cu2+在加熱過程中水解,以獲得純凈的硫酸銅晶體;
(6)由硫酸銅溶液獲得硫酸銅晶體的方法為蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,故答案為:蒸發濃縮、冷卻結晶.
點評 本題考查了銅的化合物的性質、制備、提純除雜,利用題給信息,應用難溶物質在不同PH溶液中沉淀的程度不同進行除雜分離的步驟和原理,同時考查了實驗基本操作,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 鐵粉作袋裝食品的抗氧化劑 | B. | 二氧化硫作紙漿的漂白劑 | ||
| C. | 氫氟酸作普通玻璃的刻蝕劑 | D. | 有機溶劑作食用油的萃取劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | 反應條件 | 時間 | NO/mol | Cl2/mol | NOCl/mol |
| 實驗① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 實驗② | T、恒壓 | 初始 | 0.2 | 0.1 | 0 |
| A. | 實驗①中,0~10min內,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡時若升高溫度,達到新平衡時K=400,則該反應△H>0 | |
| C. | 平衡時實驗②比實驗①的Cl2轉化率大 | |
| D. | 若實驗①起始只充入0.4molNOCl,則平衡時NOCl濃度大于0.15mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
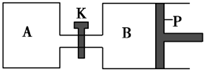 如圖所示的裝置中發生反應2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑動的活塞.在相同溫度時關閉K,向A、B容器中分別充入2mol A2和1mol B2,兩容器分別在500℃時達平衡,A中C的濃度為w1 mol•L-1,放出熱量b kJ,B中C的濃度為w2 mol•L-1,放出熱量c kJ.下列說法錯誤的是( )
如圖所示的裝置中發生反應2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑動的活塞.在相同溫度時關閉K,向A、B容器中分別充入2mol A2和1mol B2,兩容器分別在500℃時達平衡,A中C的濃度為w1 mol•L-1,放出熱量b kJ,B中C的濃度為w2 mol•L-1,放出熱量c kJ.下列說法錯誤的是( )| A. | 此反應的平衡常數表達式為K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的濃度大小比較為:w2<w1 | |
| C. | a、b、c由大到小的關系為a>c>b | |
| D. | 若打開K,一段時間后重新達平衡,容器B的體積將減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 1.0MPa | 2.0MPa | 3.0MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
| A. | 1個 | B. | 2個 | C. | 3個 | D. | 4個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干燥的氯氣可以貯存在鋼瓶中 | |
| B. | 氯氣是一種黃綠色的,強烈刺激性氣味的有毒氣體 | |
| C. | 工業上常用電解熔融氯化鈉的方法制備氯氣 | |
| D. | 氯氣能給水進行消毒是因為氯氣與水反應生成了HClO |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com