
分析 已知生成1mol SO3放熱a kJ,經4s后達到平衡狀態,測得放熱b kJ,可知生成$\frac{b}{a}$molSO3,由方程式2SO2(g)+O2(g)?2SO3(g)可知O2、SO2的消耗量,進而計算反應速率、轉化率等.
解答 解:已知生成1mol SO3放熱a kJ,經4s后達到平衡狀態,測得放熱b kJ,可知生成$\frac{b}{a}$molSO3,
由方程式2SO2(g)+O2(g)?2SO3(g)可知消耗$\frac{1}{2}×$$\frac{b}{a}$molO2,
則v(O2)=$\frac{\frac{\frac{1}{2}×\frac{b}{a}mol}{2L}}{4s}$=$\frac{b}{16a}$mol•L-1•s-1,
由方程式可知消耗$\frac{b}{a}$molSO2,
SO2的轉化率為$\frac{\frac{b}{a}mol}{mmol}×100%$=$\frac{b}{am}$×100%.
故答案為:$\frac{b}{16a}$mol•L-1•s-1;$\frac{b}{am}$×100%.
點評 本題考查化學平衡計算,為高頻考點,側重于學生的分析、計算能力的考查,注意把握反應速率、轉化率的計算,把握相關計算公式的運用,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 開始沉淀時pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀時pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 硫酸生產中爐氣轉化反應為:2SO2(g)+O2(g)?2SO3(g).研究發現,SO3的體積分數(SO3%)隨溫度(T)的變化如曲線I所示.下列判斷正確的是( )
硫酸生產中爐氣轉化反應為:2SO2(g)+O2(g)?2SO3(g).研究發現,SO3的體積分數(SO3%)隨溫度(T)的變化如曲線I所示.下列判斷正確的是( )| A. | 該反應在高溫時比低溫更易自發進行 | |
| B. | 曲線I上A、C兩點反應速率的關系是:vA<vC | |
| C. | T0時該反應的平衡常數為160 | |
| D. | 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化劑的曲線,則II是Fe2O3作催化劑的曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
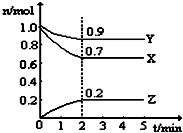 某溫度時,在一個5L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據填空:
某溫度時,在一個5L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 判斷該反應達到平衡的依據是CO、H2O、CO2、H2的濃度都相等 | |
| B. | 反應放出的熱量為0.04 a kJ | |
| C. | 平衡時H2O的轉化率為40% | |
| D. | 若將容器的體積壓縮為1 L,有利于該反應平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1項 | B. | 2項 | C. | 3項 | D. | 4項 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com