
分析 利用化學平衡三段式計算各組分的濃度,根據v=$\frac{△c}{△t}$計算出用O2的濃度變化表示2min內的化學反應速率,根據平衡常數公式K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$計算出該反應的平衡常數.
解答 解:平衡時SO3的濃度為0.5mol•L-1,則:
2SO2(g)+O2(g)?2SO3(g),
起始量(mol•L-1) 1 0.5 0
變化量(mol•L-1) 0.5 0.25 0.5
平衡量(mol•L-1) 0.5 0.25 0.5
用O2的濃度變化表示2min內的化學反應速率為:v(O2)=$\frac{0.25mol/L}{2min}$=0.25mol/(L•min);
該反應的平衡常數K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.{5}^{2}}{0.{5}^{2}×0.25}$=4,
故答案為:0.25mol/(L•min);
點評 本題考查了化學平衡的計算,題目難度不大,明確化學平衡常數、化學反應速率的概念及表達式為解答關鍵,注意掌握三段式在化學平衡計算中的應用,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 將鐵粉加入稀硫酸中:Fe+2H+═Fe2++H2↑ | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | MnO2與濃鹽酸反應制Cl2:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 鋁電池性能優越,Al-AgO電池可用作水下動力電源,其原理如圖所示.該電池反應的化學方程式為2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
鋁電池性能優越,Al-AgO電池可用作水下動力電源,其原理如圖所示.該電池反應的化學方程式為2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
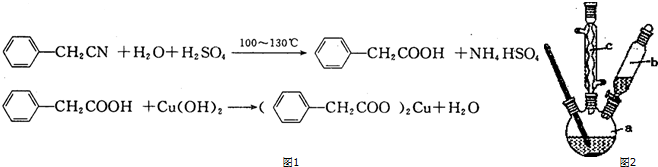
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 開始沉淀時pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀時pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
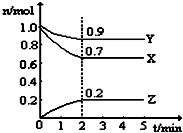 某溫度時,在一個5L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據填空:
某溫度時,在一個5L的恒容容器中,X、Y、Z均為氣體,三種物質的物質的量隨時間的變化曲線如圖所示.根據圖中數據填空:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
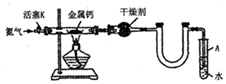
| 空瓷舟質量m0/g | 瓷舟與鈣的質量m1/g | 瓷舟與產物的質量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com