
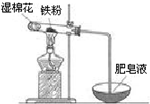
 鐵是日常生活中用途最廣、用量最大的金屬材料.
鐵是日常生活中用途最廣、用量最大的金屬材料.分析 (1)根據鐵和濃硫酸鈍化的原理解答;
(2)①濕棉花含有水蒸氣,對反應來說提供了水,鐵在高溫下與水反應生成四氧化三鐵和氫氣,據此分析解答即可;
②產物四氧化三鐵中有+2價的鐵和+3價的鐵,還有可能有過量的鐵;
(3)①鐵是金屬具有還原性,濃硫酸具有氧化性,鐵被氧化成+3價鐵,濃硫酸被還原成+4價的硫;
②碳單質和濃硫酸在加熱的條件下生成二氧化碳和二氧化硫;
③生成的SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,結合關系式:SO2→BaSO4求出SO2的體積分數.
解答 (1)常溫下,鐵在濃硫酸中發生鈍化現象使鐵表面形成一層致密穩定的氧化膜,故鐵制品容器可以盛放濃硫酸,
故答案為:濃硫酸使鐵表面形成一層致密穩定的氧化膜;
(2)①因為是鐵和水蒸氣的反應,試管內有鐵粉,所以濕棉花主要是提供水蒸氣;鐵在高溫下與水反應生成四氧化三鐵和氫氣,反應方程式為:3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2,
故答案為:提供水蒸氣;3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;
②鐵和水蒸氣反應,產物為四氧化三鐵和氫氣,加入過量鹽酸,固體完全溶解,必發生反應:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,所以所得溶液中存在的陽離子是一定有Fe2+、H+,四氧化三鐵黑色固體中可能含有過量的鐵,可能將三價鐵離子全部轉化成二價鐵離子,Fe+2Fe3+═3Fe2+,所以所得溶液中存在的陽離子是一定有Fe2+、H+,可能有Fe3+,
故答案為:b;
(3)①鐵和濃硫酸反應鐵被氧化成+3價鐵,濃硫酸被還原成+4價的硫,生成硫酸鐵和二氧化硫和水,
反應方程式為:2Fe+6H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O
故答案為:2Fe+6H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
②在反應的過程中,碳單質可以和濃硫酸反應生成二氧化碳、二氧化硫等氣體,
故答案為:C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2SO2+2H2O;
③SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,離子方程式的書寫,將產物中的氫溴酸和硫酸拆成離子,所以離子方程式為:SO2+Br2+2H2O═2Br-+SO42-+4H+,生成的硫酸遇到氯化鋇會產生白色沉淀,可以先洗滌然后再過濾來獲得純凈的硫酸鋇沉淀,則n(混合氣體)=$\frac{0.672L}{22.4L/mol}$=0.03mol,
SO2 ~BaSO4
1mol 233g
n 4.66g
n=0.02mol,
則 SO2的體積分數:$\frac{0.02}{0.03}$×100%=$\frac{2}{3}$,
故答案為:SO2+Br2+2H2O═2Br-+SO42-+4H+;$\frac{2}{3}$.
點評 本題考查鐵及其化合物的性質實驗,結合相關的化學反應原理是解答的關鍵,本題難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,0.1 mol/L CH3COONa溶液中,CH3COO-個數小于0.1NA | |
| B. | K、Zn分別與稀硫酸反應所得溶液均呈中性 | |
| C. | Fe分別與氯氣和稀鹽酸反應所得氯化物相同 | |
| D. | C、P、S、Cl的最高價氧化物對應水化物的酸性逐漸增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗操作 | 預期現象與結論 |
| 步驟1:取適量“吸收液”于小燒杯中,用膠頭滴管取1mol/L BaCl2溶液向小燒杯滴加直至過量. | 若出現白色渾濁,則溶液中存在SO32-或 SO42-. |
| 步驟2:將小燒杯中的濁液過濾、洗滌,再用適量水把附在濾紙上的固體沖入另一小燒杯中;向沖下的固體滴入1滴(或少量)品紅,再滴入過量2mol/L鹽酸,振蕩. | |
| 步驟3:用試管取適量濾液,向其中(或小燒杯中)滴入過量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品紅溶液,再滴入2-3滴(或過量)的2mol/L鹽酸],振蕩 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 珍珠、瑪瑙、紅寶石、水晶的主要成分都是硅酸鹽 | |
| B. | 工業上冶煉金屬Mg、Cu都采用熱還原法 | |
| C. | 氯水、醋酸、小蘇打都是電解質 | |
| D. | 利用丁達爾效應可以區別NaCl溶液和Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 白色沉淀是CuI2,棕色溶液含有I2 | |
| B. | 滴加KI溶液時,轉移1mol電子時生成1mol白色沉淀 | |
| C. | 通入SO2時,SO2與I2反應,I2作還原劑 | |
| D. | 上述實驗條件下,物質的氧化性:I2>Cu2+>SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤的干餾是化學變化,而煤的氣化、液化是物理變化 | |
| B. | 石油裂解是為了獲得更多汽油,以滿足迅速增長的汽車需要 | |
| C. | 氫能、電能、風能都是無毒、無污染的綠色新能源,可以安全使用 | |
| D. | 玻璃是將石灰石、純堿、石英在玻璃熔爐中高溫熔融制得的 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com