
分析 (1)根據根據碳酸鈉的溶解度知,121.2g飽和碳酸鈉溶液中碳酸鈉的質量為21.2g,溶劑的質量是100g,從而可知碳酸鈉的物質的量,繼而能求出生成的碳酸氫鈉的質量,然后根據剩余的溶劑的質量,結合碳酸氫鈉的溶解度,故可以求出溶解的碳酸氫鈉的質量,從而可以求出析出的質量;
(2)2.24L(標況下)CO2氣體的物質的量為0.1mol,二氧化碳完全反應,
若只發生:CO2+2KOH=K2CO3+H2O,則生成0.1mol的K2CO3,其質量=0.1mol×138g/mol=13.8g;
若只發生:CO2+KOH=KHCO3,則生成0.1mol的KHCO3,其質量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固體是K2CO3和KHCO3的混合物,
設白色固體中K2CO3 x mol,KHCO3 y mol,根據C元素守恒及二者質量列方程計算,再根據鉀離子守恒計算KOH物質的量,根據c=$\frac{n}{V}$計算KOH溶液物質的量濃度;
(3)根據反應可知,當2molNaOH生成時,溶液增重44g,設生成的氫氧化鈉的物質的量為xmol,根據反應求解;
(4)由②③可知,一定量的甲與乙反應時,乙的量越多,生成的沉淀越少,則乙為NaOH溶液,即甲為AlCl3溶液;根據①中發生AlCl3+3NaOH═Al(OH)3↓+3NaCl,堿不足來計算NaOH溶液的物質的量濃度;根據②中發生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假設出最大沉淀量,并利用生成的沉淀的量來計算AlCl3溶液的濃度.
解答 解:(1)20℃時,根據碳酸鈉的溶解度知,121.2g飽和碳酸鈉溶液中碳酸鈉的質量為21.2g,溶劑的質量是100g,100g水中溶解碳酸氫鈉的質量為9.6g,根據鈉原子守恒知,生成碳酸氫鈉的質量=$\frac{21.2g}{106g/mol}$×2×84g/mol═33.6g,根據Na2CO3+H2O+CO2=2NaHCO3知,21.2g碳酸鈉參加反應需要水的質量=$\frac{21.2g}{106g/mol}$×18g/mol=3.6g,所以溶劑的質量為100g-3.6g=96.4g,
溶解碳酸氫鈉的質量=$\frac{9.6g}{100g}$×96.4g=9.3g,所以析出碳酸氫鈉的質量=33.6g-9.3g=24.3g,
故答案為:24.3;
(2)2.24L(標況下)CO2氣體的物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,
若只發生:CO2+2KOH=K2CO3+H2O,則生成0.1mol的K2CO3,其質量=0.1mol×138g/mol=13.8g,
若只發生:CO2+KOH=KHCO3,則生成0.1mol的KHCO3,其質量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固體是K2CO3和KHCO3的混合物;
設白色固體中K2CO3 x mol,KHCO3 y mol,
根據碳原子守恒,有:x mol+y mol=0.1 mol,
由二者質量可知:138g•mol-1×x mol+100 g•mol-1×y mol=11.9g
聯立方程,解得x=0.05mol y=0.05mol
原溶液中KOH物質的量為 2xmol+ymol=2×0.05mol+0.05mol=0.15mol,所用KOH溶液物質的量濃度為$\frac{0.15mol}{0.5L}$=0.3mol•L-1,
故答案為:0.3;
(3)根據反應可知,當2molNaOH生成時,溶液增重44g,設生成的氫氧化鈉的物質的量為xmol,則有:
2Na+2H2O=2NaOH+H2↑
2mol△m=44g
xmol 11g
則有:$\frac{2}{x}=\frac{44}{11}$
解得x=0.5mol
故生成的氫氧化鈉的質量為m=0.5mol×40g/mol=20g
則溶液質量分數=$\frac{20g}{100g}×100%=20%$.
故答案為:20%;
(4)由②③可知,一定量的甲與乙反應時,乙的量越多,生成的沉淀越少,則乙為NaOH溶液,即甲為AlCl3溶液,
在①中發生AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物質的量為$\frac{1.56g}{78g/mol}$=0.02mol,堿不足,完全反應,
則NaOH的物質的量為0.02mol×3=0.06mol,故NaOH溶液的物質的量濃度為$\frac{0.06mol}{0.12L}$=0.5mol/L,
在②中發生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假設出沉淀最大量xmol,開始沉淀過程消耗氫氧根離子3xmol,
沉淀溶解過程氫氧化鋁與氫氧化鈉1:1反應,最后生成0.02mol氫氧化鋁,所以消耗氫氧化鈉(x-0.02)mol,
則一共消耗氫氧化鈉為3x+(x-0.02)=0.44L×0.5mol/L=0.22mol,解得x=0.06mol,即最多有氫氧化鋁0.06mol,所以原溶液含鋁離子0.06mol,
氯化鋁濃度為$\frac{0.06mol}{0.12L}$=0.5mol/L,
故答案為:AlCl3;0.5;NaOH;0.5.
點評 本題考查化學方程式的有關計算,為高頻考點,明確氫氧化鋁性質是解本題關鍵,知道氧化鋁和氫氧化鈉溶液滴加順序不同導致其產物不同,側重考查學生分析計算能力,題目難度中等.


 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 取用Na2CO3溶液時,發現取量過多,為了不浪費,又把過量的試劑倒入試劑瓶中 | |
| B. | 用溶解、過濾的方法分離氯化鈉和硝酸鉀的混合物 | |
| C. | 稱量NaOH固體,先在天平兩盤上放大小相等紙片,然后NaOH放在左盤紙片上稱量 | |
| D. | 利用丁達爾效應可以區別溶液和膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
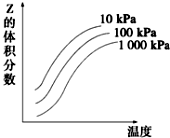 圖是溫度和壓強對X+Y?2Z反應影響的示意圖.圖中橫坐標表示溫度,縱坐標表示平衡時混合氣體中Z的體積分數.下列敘述正確的是( )
圖是溫度和壓強對X+Y?2Z反應影響的示意圖.圖中橫坐標表示溫度,縱坐標表示平衡時混合氣體中Z的體積分數.下列敘述正確的是( )| A. | 上述可逆反應的正反應為放熱反應 | B. | X、Y、Z均為氣態 | ||
| C. | 增大壓強平衡向正反應方向移動 | D. | 上述反應的逆反應的△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 重氫原子:${\;}_{1}^{2}$D | |
| B. | S2-的結構示意圖: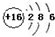 | |
| C. | 質子數為53,中子數為78的碘原子:${\;}_{53}^{131}$I | |
| D. | N2的電子式: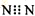 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯和液溴在FeBr3催化作用下生成溴苯 | |
| B. | 丙烯和氯氣在一定條件下反應生成ClCH2CH=CH2的反應 | |
| C. | 乙烯使酸性高錳酸鉀溶液褪色 | |
| D. | 乙烯與HCl氣體反應生成一氯乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤、石油是不可再生能源,天然氣是可再生能源 | |
| B. | 在化學反應中,反應物轉化為生成物的同時,必然發生能量的變化 | |
| C. | 熱值指在一定條件下,1mol的物質完全燃燒所放出的熱量 | |
| D. | 若化學過程中斷開化學鍵放出的能量大于形成化學鍵所吸收的能量,則反應放熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中氫氣作還原劑,鋁作氧化劑 | B. | B2H6充分燃燒生成B2O3和H2O | ||
| C. | B2H6中存在共價鍵和離子鍵 | D. | 每生成1molB2H6轉移3mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
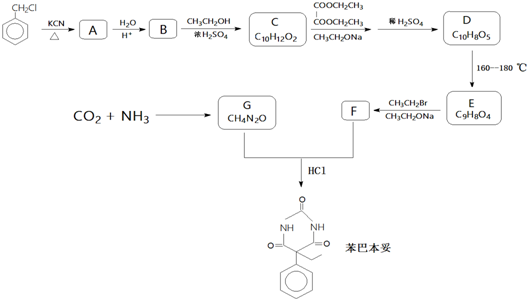
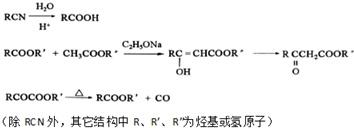
 ;E→F的反應類型取代反應
;E→F的反應類型取代反應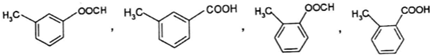 (其中一種).
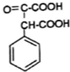
(其中一種). 和苯環結構;
和苯環結構;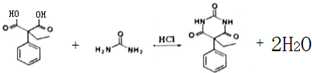 .
.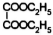 )的合成路線(用流程圖表示;無機試劑任選).
)的合成路線(用流程圖表示;無機試劑任選).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com