
| A. | 當△H為“-”時,表示該反應為吸熱反應 | |
| B. | 化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關 | |
| C. | H2S的燃燒熱△H=-a kJ•mol-1,則表示H2S燃燒熱的熱化學方程式為2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反應熱的大小與反應物所具有的能量和生成物所具有的能量無關 |
分析 A.△H<0為放熱反應;
B.反應熱的大小取決于反應體系的始態和終態,與過程無關;
C.燃燒熱是指1mol可燃物完全燃燒生成穩定的氧化物放出的熱量;
D.反應熱(△H)=生成物的總能量-反應物的總能量.
解答 解:A.△H<0為放熱反應,即當△H為負值時,表示該反應為放熱反應,故A錯誤;
B.反應熱的大小取決于反應體系的始態和終態,與過程無關,遵循能量守恒定律,故B正確;
C.H2S的燃燒熱△H=-a kJ•mol-1,則表示H2S燃燒熱的熱化學方程式為H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-a kJ•mol-1,故C錯誤;
D.反應熱(△H)=生成物的總能量-反應物的總能量,則反應熱的大小與反應物所具有的能量和生成物具有的能量有關,故D錯誤.
故選B.
點評 本題考查了反應熱的含義、燃燒熱、放熱反應和吸熱反應,熟記常見的放熱反應和吸熱反應,理解△H的含義是解答的關鍵,題目較簡單.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
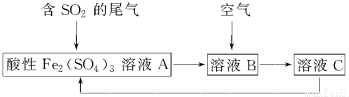
| A. | 溶液B中發生的反應為2SO2+O2═2SO3 | |
| B. | 可用酸性高錳酸鉀溶液檢驗溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工藝的優點之一是物質能循環利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
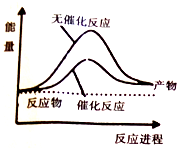 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸發1mol CH3OH(l)需要吸收的能量為157kJ,相關數據如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸發1mol CH3OH(l)需要吸收的能量為157kJ,相關數據如下| H2(g) | CO(g) | CH3OH(g) | |
| 1mol分子中的化學鍵形成時要釋放出的能量/kJ | 436 | 1084 | a |
| A. | 上圖可表示合成甲醇過程中的能量變化 | |
| B. | a的數值為2047 | |
| C. | Q的數值為91 | |
| D. | 其它條件相同,反應使用催化劑時釋放出的能量大于無催化劑時釋放出的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氮原子的質量就是氮的相對原子質量 | |
| B. | 氦氣的摩爾質量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的質量是18g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
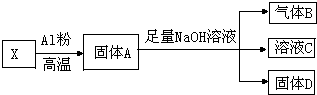 某同學設計實驗將Fe3O4和CuO組成的混合物X進行如圖所示的轉化(每一步均反應完全)
某同學設計實驗將Fe3O4和CuO組成的混合物X進行如圖所示的轉化(每一步均反應完全)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
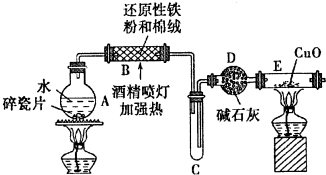
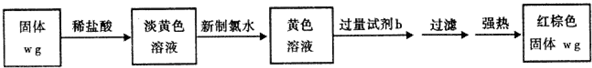
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
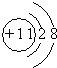 ;
;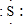 ,E離子的符號為Cl-;
,E離子的符號為Cl-;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com