
分析 (1)根據蓋斯定律來計算丙烷完全燃燒的反應熱;
(2)①利用平衡的特征“等”、“定”及由此衍生的一些量來分析;
②根據CO的轉化率計算CO的濃度變化量,利用三段式計算各組分的濃度變化量、平衡時各組分的濃度,將平衡濃度代入平衡常數表達式計算該反應的平衡常數.
解答 解:(1)由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O(l)△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,
根據蓋斯定律可知,$\frac{①+②×③}{2}$可得C3H8(g)+5O2 (g)=3CO2 (g)+4H2O(l),其反應熱為$\frac{(-2741.8kJ/mol)+(-566kJ/mol)×3}{2}$=-2219.9KJ/mol,
故答案為:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2219.9kJ/mol;
(2)①a.由反應可知,反應前后的壓強始終不變,則體系中的壓強不發生變化,不能判斷平衡,故a錯誤;
b.v正(H2)=v逆(CO),正反應速率等于逆反應速率,達到平衡,故b正確;
c.氣體的總質量不變,總物質的量不發生變化,不能判斷平衡,故c錯誤;
d.CO2的濃度不再發生變化,由平衡的特征“定”可知,則化學反應達到平衡,故d正確;
故答案為:bd;
②C3H8在不足量的氧氣里燃燒,生成CO和CO2以及氣態水,所以起始有CO2,根據元素守恒可知,當水為2.4mol/L、CO為1mol/L時,二氧化碳為0.8mol/L,達到平衡后,CO的轉化率為60%,則CO的濃度變化量=1mol/L×60%=0.6mol/L,則;
CO(g)+H2O(g)?CO2(g)+H2(g)
開始(mol/L):1 2.4 0.8 0
變化(mol/L):0.4 0.4 0.4 0.4
平衡(mol/L):0.6 2.0 1.2 0.4
平衡常數k=$\frac{1.2×0.4}{0.6×2.0}$=0.4,
故答案為:0.4.
點評 本題考查化學平衡的有關計算,題目難度中等,注意掌握影響平衡移動的因素,把握平衡轉化率的計算和應用,難點是化學平衡狀態的判斷,要抓住平衡的特征判斷,屬基礎考查.


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能與NaOH溶液反應的同分異構體共有6種 | |
| B. | 存在分子中含有六元環的同分異構體 | |
| C. | 既含有羥基又含有醛基的有5種 | |
| D. | 不存在含有2個羥基的同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室用氯化銨溶液和氫氧化鈣溶液混合制取氨氣 | |
| B. | 雷雨天氣時空氣中能生成少量的氮氧化物 | |
| C. | 銨鹽易溶于水,化學性質穩定,受熱不易分解 | |
| D. | O2、NO、NO2都能用濃硫酸干燥,且通常情況下能共存 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
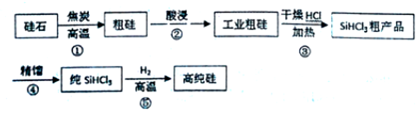
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
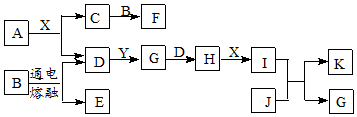
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定物質的量濃度的溶液配制過程中,仰視定容,所得溶液的濃度偏大 | |
| B. | 相同體積和相同物質的量濃度的不同溶液里所含溶質的物質的量相同 | |
| C. | 溶液中溶質質量分數為w,密度為ρ g/cm3,溶質摩爾質量為M g/mol的溶液的物質的量濃度為$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的濃鹽酸與H2O等質量混合所得混合液的濃度為5 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com