
工業上常回收冶煉鋅廢渣中的鋅(含有ZnO、FeO、Fe2O3、CuO、Al2O3等雜質),并用來生產Zn(NO3)2·6H2O晶體,其工藝流程為:
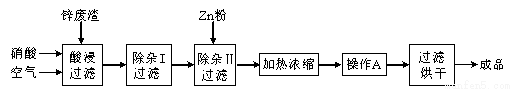
有關氫氧化物開始沉淀和沉淀完全的pH如下表:
氫氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
開始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步驟中,為提高鋅的浸出速率,除通入空氣“攪拌”外,還可采取的措施是 。
⑵上述工藝流程中多處涉及“過濾”,實驗室中過濾操作需要使用的玻璃儀器有 。
⑶在“除雜I”步驟中,需再加入適量H2O2溶液,H2O2與Fe2+反應的離子方程式為 。為使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,應控制溶液的pH范圍為 。檢驗Fe3+是否沉淀完全的實驗操作是 。
⑷加入Zn粉的作用是 。“操作A”的名稱是 。
(1)適當升高反應溫度(或增大硝酸濃度、將鋅廢渣粉碎等);(2)燒杯、玻璃棒、漏斗;(3)2Fe2++H2O2+2H+=2Fe3++2H2O 5.2~5.4 靜置,取少量上層清液,滴加KSCN溶液,若不出現紅色,則表明Fe3+沉淀完全 (4)除去溶液中的Cu2+ 冷卻結晶
【解析】
試題分析:⑴影響化學反應速率的因素有濃度、溫度、固體顆粒的大小等。所以在“酸浸”步驟中,為提高鋅的浸出速率,除通入空氣“攪拌”外,還可采取的措施是適當升高反應溫度(或增大硝酸濃度、將鋅廢渣粉碎等)。(2)在實驗室中過濾操作需要使用的玻璃儀器有燒杯、玻璃棒、漏斗。⑶在“除雜I”步驟中,需再加入適量H2O2溶液,H2O2有氧化性,而Fe2+有還原性,二者容易發生氧化還原反應。根據電子守恒、電荷守恒及原子守恒可得H2O2與Fe2+反應的離子方程式為2Fe2++H2O2+2H+=2Fe3++2H2O。為使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,根據物質開始形成沉淀和沉淀完全時的pH 的大小,的應控制溶液的pH范圍為5.2~5.4。檢驗Fe3+是否沉淀完全的原理就是利用Fe(SCN)3的血紅色;實驗操作是靜置,取少量上層清液,滴加KSCN溶液,若不出現紅色,則表明Fe3+沉淀完全。⑷由于溶液中還含有Cu2+。為了制取純凈的Zn(NO3)2·6H2O晶體,應該把雜質除雜。加入Zn粉的作用是除去溶液中的Cu2+,反應方程式為Zn+ Cu2+= Cu+ Zn2+。將溶液蒸發濃縮、冷卻結晶然后過濾烘干即得到Zn(NO3)2 ·6H2O晶體。
考點:考查影響化學反應速率的因素、化學儀器的使用、混合物的分離、離子方程式的書寫的知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015屆江蘇省淮安市協作體高二下學期期中考試化學試卷(解析版) 題型:填空題
一定溫度下,在溶劑為1L的密閉容器內放入2molN2O4和8molNO2,發生如下反應2 NO2(紅棕色) N2O4(無色) △H<0反應中NO2 、N2O4的物質的量隨反應時間變化的曲線如下圖,按下列要求作答:
N2O4(無色) △H<0反應中NO2 、N2O4的物質的量隨反應時間變化的曲線如下圖,按下列要求作答:

(1)在該溫度下,反應的化學平衡常數表達式為: 。
(2)若t1=10s,t2=20s,計算從t1至t2時以N2O4表示的反應速率: mol· L-1· s-1。
(3)圖中t1、t2、t3哪一個時刻表示反應已經達到平衡?答: 。
(4)t1時,正反應速率 (填“>”、“<”或“=”)逆反應速率。
(5)維持容器的溫度不變,若縮小容器的體積,則平衡向 移動(填“正反應方向”、“逆反應方向”或“不變”)
(6)維持容器的體積不變,升高溫度,達到新平衡時體系的顏色 (填“變深”、“變淺”或“不變”)。
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省沭陽縣高二下學期期中調研測試化學試卷(解析版) 題型:選擇題
下列有關工業生產的敘述正確的是
A.合成氨工業中,將NH3及時液化分離有利于加快反應速率
B.氯堿工業中,使用離子交換膜可防止C12和NaOH溶液反應
C.硫酸工業中,接觸室內安裝熱交換器,是為了利用沸騰爐中排出的SO2的熱量
D.硫酸工業中,SO2的催化氧化不采用高壓,是因為壓強對SO2轉化率無影響
查看答案和解析>>
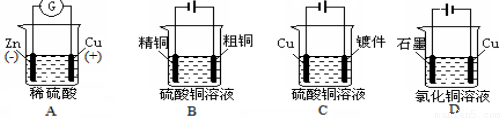
科目:高中化學 來源:2015屆江蘇省無錫江陰市高二下學期期中考試化學試卷(解析版) 題型:選擇題
下列圖示中關于銅電極的連接錯誤的是
銅鋅原電池 電解精煉銅 鍍件上鍍銅 電解氯化銅溶液
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省無錫江陰市高二下學期期中考試化學試卷(解析版) 題型:選擇題
下列化學反應屬于吸熱反應的是
A.碘的升華 B.生石灰溶于水
C.鎂與稀鹽酸反應 D.熟石灰與NH4Cl晶體混合制氨
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省高二下學期4月階段測試化學試卷(解析版) 題型:選擇題
一定條件下存在反應:A(g)+B(g)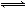 C(g)+D(g) ΔH<0。現有三個相同的2 L恒容絕熱(與外界沒有熱量交換)密閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃條件下開始反應。達到平衡時,下列說法正確的是
C(g)+D(g) ΔH<0。現有三個相同的2 L恒容絕熱(與外界沒有熱量交換)密閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃條件下開始反應。達到平衡時,下列說法正確的是
A.容器Ⅰ、Ⅱ中正反應速率相同
B.容器Ⅰ、Ⅲ中反應的平衡常數相同
C.容器Ⅰ中A的物質的量比容器Ⅱ中的多
D.容器Ⅰ中A的轉化率與容器Ⅱ中C的轉化率之和小于1
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省高二下學期4月階段測試化學試卷(解析版) 題型:選擇題
下列與含氯化合物有關的說法正確的是
A.HClO是弱酸,所以NaClO是弱電解質
B.向沸水中逐滴加入少量飽和FeCl3溶液,可制得Fe(OH)3膠體
C.HCl溶液和NaCl溶液均通過離子導電,所以HCl和NaCl均是離子化合物
D.電解NaCl溶液得到22.4 L H2(標準狀況),理論上需要轉移NA個電子
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省高三上學期摸底考試化學試卷(解析版) 題型:選擇題
近年來高鐵酸鉀(K2FeO4)已經被廣泛應用在水處理方面,高鐵酸鉀的氧化性超過高錳酸鉀,是一種集氧化、吸附、凝聚、殺菌的新型高效的多功能水處理劑。高鐵酸鉀在水處理過程中涉及到的過程正確的有:
①蛋白質的變性 ②蛋白質的鹽析 ③膠體的聚沉 ④鹽類水解 ⑤焰色反應 ⑥氧化還原反應
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化學 來源:2015屆廣西桂林市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
某反應體系中存在下列六種物質:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反應物之一。下列說法不正確的是
A、該反應屬于氧化還原反應
B、此反應中只有砷元素被氧化,只有氮元素被還原
C、HNO3、H2O是反應物,H2SO4、NO、H3AsO4是生成物
D、HNO3、H2SO4、H3AsO4都是最高價氧化物對應的水化物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com