
某反應體系中存在下列六種物質:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反應物之一。下列說法不正確的是
A、該反應屬于氧化還原反應
B、此反應中只有砷元素被氧化,只有氮元素被還原
C、HNO3、H2O是反應物,H2SO4、NO、H3AsO4是生成物
D、HNO3、H2SO4、H3AsO4都是最高價氧化物對應的水化物
 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源:2015屆江蘇省高二下學期4月階段測試化學試卷(解析版) 題型:填空題
工業上常回收冶煉鋅廢渣中的鋅(含有ZnO、FeO、Fe2O3、CuO、Al2O3等雜質),并用來生產Zn(NO3)2·6H2O晶體,其工藝流程為:
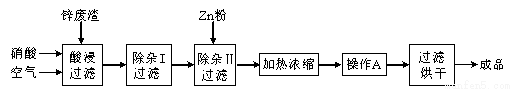
有關氫氧化物開始沉淀和沉淀完全的pH如下表:
氫氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
開始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步驟中,為提高鋅的浸出速率,除通入空氣“攪拌”外,還可采取的措施是 。
⑵上述工藝流程中多處涉及“過濾”,實驗室中過濾操作需要使用的玻璃儀器有 。
⑶在“除雜I”步驟中,需再加入適量H2O2溶液,H2O2與Fe2+反應的離子方程式為 。為使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,應控制溶液的pH范圍為 。檢驗Fe3+是否沉淀完全的實驗操作是 。
⑷加入Zn粉的作用是 。“操作A”的名稱是 。
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省南京市高三9月學情調研卷化學試卷(解析版) 題型:實驗題
(15分)溴化鈣在醫藥上用作中樞神經抑制藥,實驗室用“尿素法”制備溴化鈣的主要流程如下:
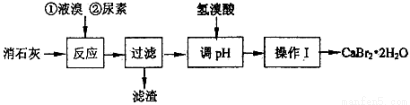
溴化鈣的部分溶解度數值如下:
溫度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(1)6Ca(OH)2+6Br2 50~70℃ 5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2轉移電子的物質的量為 ;50~70℃時,尿素[CO(NH2)2]將生成的Ca(BrO3)2還原為CaBr2,尿素被氧化為N2,該反應的化學方程式為 。
(2)過濾所需的玻璃儀器有玻璃棒、,。
(3)加入氫溴酸調pH的作用是。
(4)操作I包括、、過濾、、干燥。
(5)“二氧化硫法”制備的氫溴酸粗品中常含有少量的溴和硫酸;請選用所提供的試劑,補充完整檢驗氫溴酸粗品中是否含有Br2相SO42-的實驗方案。
限選下列試劑:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀鹽酸、植物油。
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省南京市高三9月學情調研卷化學試卷(解析版) 題型:選擇題
下列有關化學用語表示正確的是()
A.對硝基甲苯的結構簡式: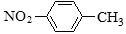 B.CH2F2的電子式:
B.CH2F2的電子式:
C.中子數為16的硫原子: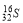 D.乙炔的最簡式:CH
D.乙炔的最簡式:CH
查看答案和解析>>
科目:高中化學 來源:2015屆廣西桂林市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A、溫度相同、體積相同的O2(g)和N2(g)分子數相同
B、等溫等壓下,SO2氣體與CO2氣體的密度之比等于16∶11
C、溫度和容積相同的兩氣罐中分別盛有5mol O2(g)和2 mol N2(g),兩容積中的壓強之比等于5∶2
D、等溫等壓條件下, 5 molO2(g)和2 molH2 (g)的體積之比等于5∶2
查看答案和解析>>
科目:高中化學 來源:2015屆廣東肇慶中學高三8月考理綜化學試卷(解析版) 題型:實驗題
(16分)“向海洋進軍”,已成為世界許多國家發展的戰略口號,海水中通常含有較多的Ca2+、Mg2+、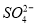 等雜質離子,以海鹽為原料的氯堿廠電解飽和食鹽水制取NaOH的工藝流程如下:
等雜質離子,以海鹽為原料的氯堿廠電解飽和食鹽水制取NaOH的工藝流程如下:
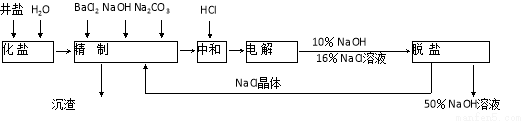
依據上圖,完成下列填空:
(1)在電解過程中,與電源正極相連的電極的電極反應式為 ;
(2)電解過程的總反應的化學方程式_________________________________________。
(3)電解槽陽極產物可用于_____________________________(至少寫出兩種用途)。
(4)工業食鹽含Ca2+、Mg2+等雜質,精制過程中除去這2種離子所發生反應的離子方程式為: 。
(5)如果粗鹽中SO42-含量較高,必須添加鋇試劑除去SO42-,該鋇試劑可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)為了有效除去Ca2+、Mg2+、SO42-加入試劑的合理順序為
a.先加NaOH,后加Na2CO3,再加鋇試劑
b.先加NaOH,后加鋇試劑,再加Na2CO3
c.先加鋇試劑,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度數據如下表:
溫度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
NaOH /g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
NaCl/ g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
根據上述數據,脫鹽工序中利用通過 、 (填操作名稱)除去NaCl。
查看答案和解析>>
科目:高中化學 來源:2015屆廣東省韶關市高三第一次模擬考試理綜化學試卷(解析版) 題型:選擇題
下列有關物質的性質和該性質的應用均正確的是
A.氯氣具有酸性,可與燒堿或石灰乳反應制備含氯消毒劑
B.濃硫酸具有強氧化性,常溫下可用鋁罐盛裝
C.氫氟酸具有弱酸性,可用氫氟酸雕刻玻璃
D.過氧化鈉具有強氧化性,可用作潛水艇中氧氣的來源
查看答案和解析>>
科目:高中化學 來源:2015屆廣東省廣州市高三上學期第一次質量檢測化學試卷(解析版) 題型:實驗題
氨氣是一種化工原料。
(1)請寫出工業上合成氨的化學方程式:
(2)實驗室中,甲、乙兩小組選擇了不同方法制取氨氣,請將實驗裝置的字母編號和制備原理填寫在下表空格中。
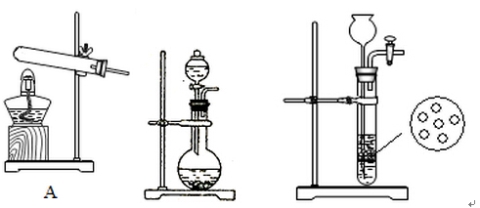
B C
| 實驗裝置 | 實驗藥品 | 制備原理 |
甲小組 | A
|
| 反應的化學方程式為 ① |
乙小組 |
| 濃氨水、氫氧化鈉固體 | 氫氧化鈉的作用:氨水中存在平衡: |
(3)請設計一個操作簡單的實驗,驗證NH3·H2O是弱電解質。
。
(4)甲同學把制得的氨氣溶于適量水中,得到稀氨水,用標準濃度的鹽酸滴定,測定其濃度。實驗步驟:準確量取10.00mL稀氨水于錐形瓶中,加入20mL水稀釋,滴加 溶液作為指示劑(填“石蕊”、“酚酞”或“甲基橙”),將 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1鹽酸裝入50ml酸式滴定管,滴定至 ,停止滴定,記錄數據。重復滴定2次。平均消耗鹽酸Vml。計算原稀氨水的物質的量濃度
= (只列出算式,不做運算)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com