
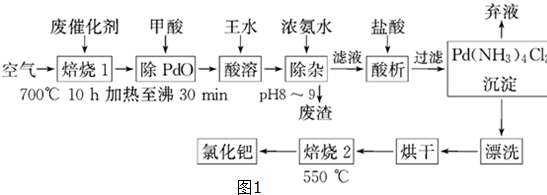
分析 廢鈀催化劑經烘干后,再在700℃的高溫下焙燒,C、Fe、Pd、有機物被氧氣氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化鐵反應生成鹽和水,PdO和甲酸發生氧化還原反應生成Pd,濾渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同時生成氣體,加入濃氨水調節溶液PH,鈀轉變為可溶性[Pd(NH3)4]2+,使鐵全部沉淀,溶液中加入鹽酸酸析得到沉淀,經過脫氨等一系列操作得當氯化鈀.
(1)廢鈀催化劑經烘干后,再在800℃的高溫下焙燒,碳和氧氣反應生成二氧化碳,Pd被氧化生成PdO,然后向固體中加入甲酸,甲酸還原PdO生成Pd、CO2和H2O;
(2)依據反應物和產物,結合鹽酸化合價變化分析電子守恒和原子守恒配平書寫化學方程式;
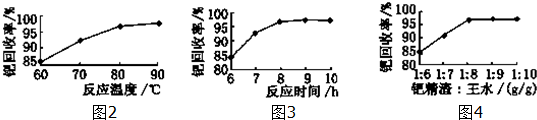
(3)根據Pd回收率與反應溫度、反應時間、鈀精渣和王水的質量比的關系確定適宜條件;
(4)加濃氨水時,鈀轉變為可溶性[Pd(NH3)4]2+,堿性溶液中鐵離子鋇沉淀為氫氧化鐵;
(5)流程分析,在700℃的高溫下焙燒,Fe,有機物被氧氣氧化生成氧化物,550℃焙燒2的目的是脫氨.
解答 解:廢鈀催化劑經烘干后,再在700℃的高溫下焙燒,Fe、Pd、有機物被氧氣氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化鐵反應生成鹽和水,PdO和甲酸發生氧化還原反應生成Pd,濾渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同時生成氣體,加入濃氨水調節溶液PH沉淀鐵離子,得到溶液中中加入鹽酸酸析得到沉淀Pd(NH3)2Cl2 ,通過脫氨等一系列操作得當氯化鈀.
(1)鈀被氧氣氧化生成PdO,PdO和HCOOH發生氧化還原反應生成Pd、CO2和H2O,反應方程式為PdO+HCOOH=Pd+CO2↑+H2O,則反應中生成的氣體產物的化學式為CO2;
故答案為:CO2;
(2)在反應中Pt元素的化合價變化為0→+2,1個Pd原子的變化數為2,N元素的化合價變化為+5→+2,1個N原子的變化數為3,則為保證化合價升降數相等,然后根據Pd原子個數相等,由N原子,Cl原子守恒,然后再根據原子守恒配氫和氧元素,得3Pd+2HNO3+12HCl═3H2PdCl4+2NO↑+4H2O,
故答案為:3Pd+2HNO3+12HCl═3H2PdCl4+2NO↑+4H2O;
(3)根據圖象知,溫度越高鈀回收率越大,反應時間越長鈀回收率越大,鈀精渣與王水的質量比越大鈀回收率越大,但90℃左右時溫度再高鈀回收率增大不大;8h后,隨著時間的增長,鈀回收率增大不大;當鈀精渣與王水的質量比為1:8后,再增大鈀精渣和王水的質量比,但鈀回收率不大,所以適宜條件是80~90℃(或90℃左右)、反應時間約為8 h、鈀精渣與王水的質量比為1:8,
故答案為:80~90℃(或90℃左右);反應時間約為8h;鈀精渣與王水的質量比為1:8;
(4)加濃氨水時,鈀轉變為可溶性[Pd(NH3)4]2+,堿性溶液中鐵離子鋇沉淀為氫氧化鐵,故答案為:Fe(OH)3;
(5)在700℃的高溫下焙燒,C、Fe,有機物被氧氣氧化生成氧化物,除去活性炭和有機物;550℃焙燒2的目的是脫氨將Pd(NH3)2Cl2變化為PdCl2,
故答案為:除去活性炭和有機物;脫氨將Pd(NH3)2Cl2變化為PdCl2.
點評 本題以Pd的提取為載體考查了工藝流程,涉及化學式的確定、氧化還原反應、圖象分析等知識點,明確物質的性質是解本題關鍵,注意從整體上分析解答,知道每一步涉及的反應、物質分離的方法等知識點,結合元素守恒分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
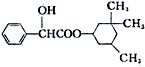 環扁桃酯具有松弛血管平滑肌、擴張血管的功能,其結構簡式如圖.下列對該物質的敘述中,正確的是( )
環扁桃酯具有松弛血管平滑肌、擴張血管的功能,其結構簡式如圖.下列對該物質的敘述中,正確的是( )| A. | 該物質屬于芳香烴 | |
| B. | 該有機物不能被氧化成醛 | |
| C. | 分子式為C17H23O3 | |
| D. | 1mol該物質最多可與2 mol NaOH發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有達到平衡時,消耗O2的速率與生成NO的速率之比才為5;4 | |
| B. | 若單位時間生成xmolNO的同時,消耗xmolNH3,則反應達到平衡狀態 | |
| C. | 達到平衡狀態后,NH3、O2、NO、H2O(g)的物質的量保持不變 | |
| D. | 達到平衡狀態時,若增加容器體積,則反應速率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 (1)NF3分子中N原子的雜化軌道類型為sp3,該分子的空間構型為三角錐形
(1)NF3分子中N原子的雜化軌道類型為sp3,該分子的空間構型為三角錐形查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
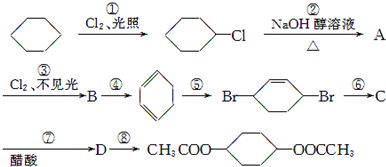
 ,C:
,C: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O
+2NaCl+2H2O
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com