
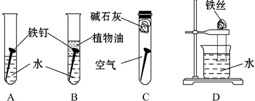
 某研究性學習小組對鐵生銹進行研究.
某研究性學習小組對鐵生銹進行研究.分析 (1)①鐵在潮濕的空氣中易發生電化學腐蝕,隔絕空氣或在干燥的空氣中難以形成原電池反應;
②鐵發生電化學腐蝕時,正極上是氧氣發生得電子的還原反應;
③將水煮沸可以將水中的空氣排出,植物油和水是互不相溶的;
④堿石灰是可以吸水的.
(2)根據金屬鐵生銹的電化學原理來解釋.
解答 解:(1)①鐵生銹的外部條件是金屬要和空氣中的水以及氧氣接觸,故答案為:和空氣以及水接觸;
②鐵釘發生電化腐蝕,負極上鐵為活潑金屬,易失去電子而被氧化,正極上是氧氣發生得電子的反應O2+2H2O+4e-=4OH-,故答案為:O2+2H2O+4e-=4OH-;
③水中溶解有一定的空氣,煮沸可以將空氣排出,植物油和水是互不相溶的,它的作用是隔絕空氣中的氧氣,故答案為:煮沸;隔絕空氣中的氧氣;
④堿石灰能吸水,它的作用是吸收空氣中的水蒸氣,故答案為:吸收空氣中的水蒸氣;
(2)鐵生銹會消耗氧氣,這樣會使試管內壓強低于大氣壓,所以液面上升的原因是鐵釘生銹消耗了試管內的氧氣,使試管內壓強低于大氣壓,不能證明水對鐵釘生銹產生影響,故答案為:鐵釘生銹消耗了試管內的氧氣,使試管內壓強低于大氣壓;不能.
點評 本題考查金屬腐蝕的化學原理,題目難度不大,注意金屬發生電化學腐蝕和化學腐蝕的區別,以及形成電化學腐蝕的條件.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
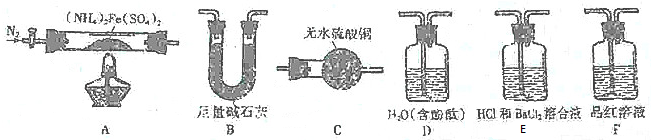
 有X、Y、Z、Q、E、M、G原子序數依次遞增的七種元素,除G元素外其余均為短周期主族元素.X的原子中沒有成對電子,Y元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子數相同,Z元素原子的外圍電子排布式為nsnnpn+1,Q的基態原子核外成對電子數是成單電子數的3倍,E與Q同周期,M元素的第一電離能在同周期主族元素中從大到小排第三位,G的陽離子是膽礬晶體中的中心離子.回答下列問題:
有X、Y、Z、Q、E、M、G原子序數依次遞增的七種元素,除G元素外其余均為短周期主族元素.X的原子中沒有成對電子,Y元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子數相同,Z元素原子的外圍電子排布式為nsnnpn+1,Q的基態原子核外成對電子數是成單電子數的3倍,E與Q同周期,M元素的第一電離能在同周期主族元素中從大到小排第三位,G的陽離子是膽礬晶體中的中心離子.回答下列問題: .
. (寫在方框內).
(寫在方框內).
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
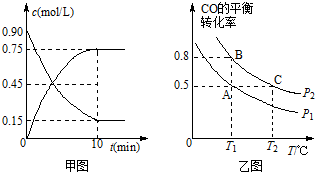
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
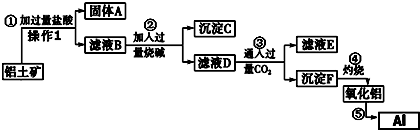
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用澄清石灰水鑒別Na2CO3和NaHCO3溶液 | |
| B. | 濃硫酸具有吸水性,可做干燥劑,但不能干燥NH3 | |
| C. | 鈉保存在煤油中,若長期放置在空氣中,最終變為NaHCO3 | |
| D. | 鎂著火后可以用CO2來滅火 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
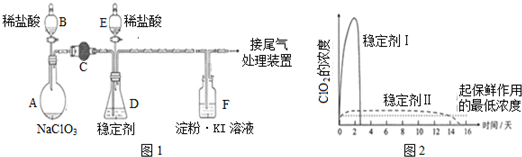
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com