
某校學生化學實驗小組,為驗證非金屬元素氯的氧化性強于硫和氮,設計了一套實驗裝置(部分夾持裝置已略去):
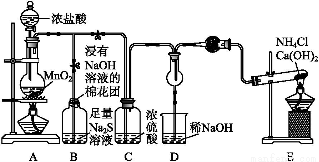
(1)寫出A中反應的離子方程式 。
(2)B中出現黃色渾濁現象,產生此現象的離子方程式 。
(3)試從原子結構角度解釋氯的氧化性大于硫的原因 。
(4)D中干燥管中出現的現象及化學方程式 。
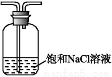
(5)有同學認為D中的現象并不能說明氯的氧化性大于氮,需要在C之前加裝洗氣裝置,請畫出其裝置圖 (并注明盛裝試劑)。
(6)還有什么方法能證明氧化性Cl2>S,用一種相關事實說明 。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)S2-+Cl2 S↓+2Cl-
S↓+2Cl-
(3)氯的原子半徑小于硫,得電子能力強于硫,所以氧化性Cl2強于S
(4)產生大量白煙,8NH3+3Cl2 6NH4Cl+N2
6NH4Cl+N2
(5)
(6)2Fe+3Cl2 2FeCl3、Fe+S
2FeCl3、Fe+S FeS
FeS
【解析】(5)E中生成NH3,往D中通的是NH3和Cl2,用NH3與Cl2反應驗證N、Cl非金屬性強弱只能用置換反應,2NH3+3Cl2 N2+6HCl,生成的HCl與NH3反應生成白煙NH4Cl,所以通入D的Cl2不能含有HCl氣體。(6)應該從非金屬性強弱比較方法的角度考慮,如與氫氣化合的難易程度、得電子能力的強弱等角度分析。
N2+6HCl,生成的HCl與NH3反應生成白煙NH4Cl,所以通入D的Cl2不能含有HCl氣體。(6)應該從非金屬性強弱比較方法的角度考慮,如與氫氣化合的難易程度、得電子能力的強弱等角度分析。


 全能測控一本好卷系列答案
全能測控一本好卷系列答案 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源:2013-2014學年高考化學二輪沖刺非選擇題增分專練 圖像、圖表練習卷(解析版) 題型:填空題
已知甲和乙在溶液中的轉化關系如圖所示: 。請回答下列問題:
。請回答下列問題:
(1)若甲是10電子的陽離子,乙是堿性氣體。1 mol乙通入足量強酸溶液中與H+反應,反應過程中的能量變化如圖。寫出乙的一種用途________________。該反應的熱化學方程式為___________________________。

(2)若甲是CO2,用CO2和NH3反應可以合成尿素,合成尿素的反應分為如下兩步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸銨) ΔH1
H2NCOONH4(l)(氨基甲酸銨) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一體積為0.5 L的密閉容器中投入4 mol氨和1 mol二氧化碳,實驗測得反應中各組分的物質的量隨時間的變化如圖Ⅰ所示。

①已知總反應的快慢由慢的一步決定,則合成尿素總反應的快慢由第________步反應決定。
②反應進行到10 min時測得CO2的物質的量如圖Ⅰ所示,則前10 min用CO2表示的第一步反應的速率為________。
③第二步反應的平衡常數K隨溫度的變化如圖Ⅱ所示,則ΔH2________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 離子反應、氧化還原反應練習卷(解析版) 題型:選擇題
解釋下列現象的化學用語正確的是( )
A.鐵釘在空氣中出現紅色的鐵銹,其負極反應式為:Fe-3e- Fe3+
Fe3+
B.氫氧化鎂白色沉淀溶于氯化銨溶液:Mg(OH)2+2N
 Mg2++2NH3·H2O
Mg2++2NH3·H2O
C.SO2通入到滴加酚酞的NaOH溶液中,紅色變淺:SO2+2OH- S
S +H2O
+H2O
D.向K2Cr2O7溶液中加入少量NaOH濃溶液,溶液由橙色變為黃色:Cr2 +H2O
+H2O 2Cr
2Cr +2H+
+2H+
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 電解質溶液與電離平衡練習卷(解析版) 題型:選擇題
常溫下,0.1 mol·L-1某一元酸HA溶液中 =1×10-12,下列說法中正確的是( )
=1×10-12,下列說法中正確的是( )
A.溶液中由水電離出的c(H+)=1×10-10 mol·L-1
B.溶液中存在HA H++A-
H++A-
C.與0.1 mol·L-1 NaOH溶液等體積混合后所得溶液為中性
D.原溶液中加入一定量NaA晶體或加水稀釋,溶液中c(OH-)均增大
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 電化學練習卷(解析版) 題型:選擇題
下圖是一套電化學裝置,對其有關說法錯誤的是( )

A.裝置A是原電池,裝置B是電解池
B.反應一段時間后,裝置B中溶液pH增大
C.a口若消耗1 mol CH4,d口可產生4 mol氣體
D.a口通入C2H6時的電極反應為C2H6-14e-+18OH- 2C
2C +12H2O
+12H2O
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構和元素周期律練習卷(解析版) 題型:選擇題
X、Y、Z、W、M五種元素的原子序數依次增大。已知X、Y、Z、W是短周期元素中的四種非金屬元素,X元素的原子形成的陰離子核外電子排布與氦原子相同,Z、W在元素周期表中處于相鄰的位置,它們的單質在常溫下均為無色氣體,Y原子的最外層電子數是內層電子數的2倍,M是地殼中含量最高的金屬元素。下列說法中正確的是( )
A.五種元素的原子半徑從大到小的順序是:M>W>Z>Y>X
B.化合物X2W2、YW2、ZW2等都含有極性共價鍵和非極性共價鍵
C.用M單質作陽極,石墨電極作陰極電解NaHCO3溶液,電解一段時間后,在陰極區會出現白色沉淀
D.X、Z兩元素能形成原子個數比為3∶1和4∶2的化合物
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構與性質(選修3)練習卷(解析版) 題型:填空題
已知A、B、C、D、E五種元素的原子序數依次增大,其中A原子所處的周期數、族序數都與其原子序數相等;B原子核外電子有6種不同的運動狀態;D原子L電子層上有2對成對電子;E+原子核外有3層電子且各層均處于全滿狀態。
請填寫下列空白。
(1)E元素基態原子的核外電子排布式為 。
(2)B、C、D三種元素的第一電離能數值由小到大的順序為 (填元素符號),其原因為 。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子軌道的雜化類型為 ;1 mol B2A4分子中含 mol σ鍵。
(4)已知D、E能形成晶胞如下圖所示的兩種化合物,化合物的化學式,甲為 ,乙為 ;高溫時,甲易轉化為乙的原因為 。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com