
X、Y、Z、W、M五種元素的原子序數依次增大。已知X、Y、Z、W是短周期元素中的四種非金屬元素,X元素的原子形成的陰離子核外電子排布與氦原子相同,Z、W在元素周期表中處于相鄰的位置,它們的單質在常溫下均為無色氣體,Y原子的最外層電子數是內層電子數的2倍,M是地殼中含量最高的金屬元素。下列說法中正確的是( )
A.五種元素的原子半徑從大到小的順序是:M>W>Z>Y>X
B.化合物X2W2、YW2、ZW2等都含有極性共價鍵和非極性共價鍵
C.用M單質作陽極,石墨電極作陰極電解NaHCO3溶液,電解一段時間后,在陰極區會出現白色沉淀
D.X、Z兩元素能形成原子個數比為3∶1和4∶2的化合物
 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源:2013-2014學年高考化學二輪沖刺非選擇題增分專練 化學工藝流程練習卷(解析版) 題型:填空題
工業上以鈦鐵礦為原料制備二氧化鈦的工藝流程如下圖所示。鈦鐵礦的主要成分為鈦酸亞鐵(FeTiO3),其中一部分鐵元素在風化過程中會轉化為+3價。
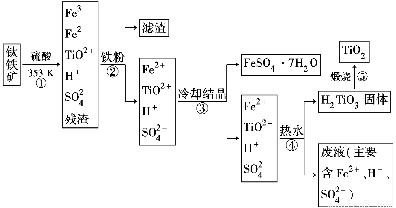
已知:TiOSO4遇水會水解。
(1)步驟②中,用鐵粉將Fe3+轉化為Fe2+的離子方程式為_______________________
(2)步驟③中,實現混合物的分離是利用物質的________(填字母序號)。
a.熔、沸點差異 b.溶解性差異 c.氧化性、還原性差異
(3)步驟②、③、④中,均需要進行的操作是________(填操作名稱)。
(4)請結合化學用語用化學平衡理論解釋步驟④中將TiO2+轉化為H2TiO3的原理:
____________________________________________________________。
(5)利用生產過程中的廢液與軟錳礦(主要成分為MnO2)反應可生產硫酸錳(MnSO4,易溶于水),該反應的離子方程式為__________________________________
(6)研究發現,用石墨作陽極、鈦網作陰極、熔融CaF2-CaO作電解質,利用如圖所示裝置可獲得金屬鈣,并可以鈣為還原劑,還原二氧化鈦制備金屬鈦。
寫出陽極的電極反應式:_________________________

在制備金屬鈦前后,CaO的總量不變,其原因是______________________________________(請結合化學用語解釋)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 離子反應、氧化還原反應練習卷(解析版) 題型:選擇題
爆竹的主要成分為硫黃、炭粉和硝酸鉀,為了一些特殊效果還加入鎂粉、鐵粉、鋁粉、銻粉及無機鹽。下列說法中不正確的是( )
A.爆竹爆炸不宜使用水來滅火,可用干沙
B.爆竹的燃放產生大量污染氣體,應加以限制
C.爆竹燃放過程中硝酸鉀作氧化劑
D.爆竹爆炸過程中發生反應為2KNO3+3C+S K2S+N2↑+3CO2↑,每生成1 mol N2轉移10NA個電子(NA表示阿伏加德羅常數的值)
K2S+N2↑+3CO2↑,每生成1 mol N2轉移10NA個電子(NA表示阿伏加德羅常數的值)
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 電化學練習卷(解析版) 題型:選擇題
已知在pH為4~5的溶液中,Cu2+幾乎不水解,而Fe3+幾乎完全水解。某學生擬用電解CuSO4溶液的方法測定銅的相對原子質量。該同學向pH=3.8酸化的、含有Fe2(SO4)3雜質的CuSO4溶液中加入過量的黑色粉末X,充分攪拌后將濾液用右圖所示裝置電解,其中某電極增重a g,另一電極上產生標準狀況下的氣體V mL。下列說法正確的是( )

A.銅電極連接電源正極
B.黑色粉末X是鐵粉
C.銅的相對原子質量的計算式是
D.石墨電極上發生的反應是4OH--4e- O2↑+2H2O
O2↑+2H2O
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構和元素周期律練習卷(解析版) 題型:實驗題
某校學生化學實驗小組,為驗證非金屬元素氯的氧化性強于硫和氮,設計了一套實驗裝置(部分夾持裝置已略去):
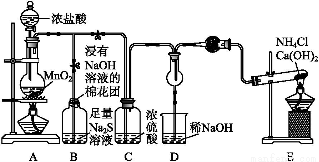
(1)寫出A中反應的離子方程式 。
(2)B中出現黃色渾濁現象,產生此現象的離子方程式 。
(3)試從原子結構角度解釋氯的氧化性大于硫的原因 。
(4)D中干燥管中出現的現象及化學方程式 。
(5)有同學認為D中的現象并不能說明氯的氧化性大于氮,需要在C之前加裝洗氣裝置,請畫出其裝置圖 (并注明盛裝試劑)。
(6)還有什么方法能證明氧化性Cl2>S,用一種相關事實說明 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構和元素周期律練習卷(解析版) 題型:選擇題
依據元素周期表及元素周期律,下列推斷中正確的是( )
A.同一周期元素的原子,半徑越小越容易失去電子
B.ⅠA族元素的金屬性比ⅡA族元素的金屬性強
C.向氫硫酸溶液中滴入氯水有單質硫生成,可以驗證硫元素的非金屬性比氯元素弱
D.主族元素的最高正化合價等于該元素原子的最外層電子數
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題復習 物質結構與性質(選修3)練習卷(解析版) 題型:填空題
A、B、C、D、E、F為前四周期元素且原子序數依次增大,其中A含有3個能級,且每個能級所含的電子數相同;C的最外層有6個運動狀態不同的電子;D是短周期元素中電負性最小的元素;E的最高價氧化物的水化物酸性最強;F除最外層原子軌道處于半充滿狀態,其余能層均充滿電子。G元素與D元素同主族,且相差3個周期。
(1)元素A、B、C的第一電離能由小到大的是 (用元素符號表示)。
(2)E的最高價含氧酸中E的雜化方式為 。
(3)F原子的外圍電子排布式為 。
(4)DE,GE兩種晶體,都屬于離子晶體,但配位數不同,其原因是 。
(5)已知DE晶體的晶胞如圖所示,若將DE晶胞中的所有E離子去掉,并將D離子全部換為A原子,再在其中的4個“小立方體”中心各放置一個A原子,且這4個“小立方體”不相鄰。位于“小立方體”中的A原子與最近的4個A原子以單鍵相連,由此表示A的一種晶體的晶胞(已知A—A鍵的鍵長為a cm,NA表示阿伏加德羅常數的數值),則該晶胞中含有 個A原子,該晶體的密度是 g·cm-3(列式表示)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com