
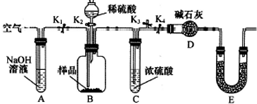
 某研究性學習小組對Cu與H2SO4反應的產物種類和性質進行探究.
某研究性學習小組對Cu與H2SO4反應的產物種類和性質進行探究.硫酸/mol•L-1 | 黑色物質出現的溫度/°C | 黑色物質消失的溫度/°C |
| 15 | 約150 | 約236 |
| 16 | 約140 | 約250 |
| 18 | 約120 | 不消失 |
分析 Ⅰ、(1)圖表數據分析銅和濃硫酸反應過程中會生成黑色物質證明有副反應,濃度合適會避免黑色固體出現,濃度越大,溫度越高黑色越難消失;
(2)CuS消失是和濃硫酸反應生成硫酸銅、二氧化硫和水;
Ⅱ、(1)沉淀為氫氧化銅的是碳酸氫鈉和硫酸銅在水溶液中發生雙水解生成分析;
(2)①空氣中含有二氧化碳,空氣通過氫氧化鈉溶液吸收空氣中的二氧化碳,利用除去二氧化碳的空氣,打開K1、K3,關閉K2、K4,排除裝置中的含二氧化碳氣體的空氣,避免測定誤差的產生;
②若沉淀樣品的質量為m g,若沉淀樣品為純凈物,則判斷沉淀為CuCO3,裝置D的質量增加了n g,為二氧化碳氣體質量,依據碳元素守恒得到mn的關系;若假設三正確,依據生成的二氧化碳物質的量減少碳酸銅質量,根據樣品質量計算得到氫氧化銅的質量分數.
解答 解:Ⅰ、(1)依據圖表數據分析可知,濃度不同時出現黑色物質的時間隨濃度增大減小,濃度為18mol/L時生成的黑色物質不能消失;
a.分析過程可知.發生的反應過程中生成二氧化硫和硫酸銅的反應過程中有奇談反應發生生成黑色物質,銅與濃硫酸反應時所涉及的反應可能不止一個,故A符合;
b.圖表數據分析可知硫酸濃度選擇適當,可避免最后產物中出現黑色物質,故B符合;
c.濃硫酸和銅的反應濃度小于15mol/L也可能出現黑色物質,出現的時間長,該反應發生的條件不一定是硫酸濃度≥15mol•L-1,故C不符合;
d.圖表數據中,18mol/L的濃硫酸,出現褐色物質的時間短,黑色物質難以消失,所以硫酸濃度越大,黑色物質越快出現、越難消失,故d符合;
故答案為:abd;
(2)CuS消失是和濃硫酸反應生成硫酸銅、二氧化硫和水,反應的化學方程式為:CuS+4H2SO4=CuSO4+4SO2↑+4H2O,
故答案為:CuS+4H2SO4=CuSO4+4SO2↑+4H2O;
Ⅱ、(1)沉淀為氫氧化銅的判斷依據是碳酸氫鈉和硫酸銅在水溶液中發生雙水解生成,反應的離子方程式為Cu2++2HCO3-=Cu (OH)2↓+2CO2↑,
故答案為:Cu2++2HCO3-=Cu (OH)2↓+2CO2↑;
(2)①空氣中含有二氧化碳,空氣通過氫氧化鈉溶液吸收空氣中的二氧化碳,利用除去二氧化碳的空氣,打開K1、K3,關閉K2、K4,排除裝置中的含二氧化碳氣體的空氣,避免測定誤差的產生;
故答案為:排盡裝置中空氣中的CO2使測定結果準確;
②若沉淀樣品的質量為100g,若沉淀樣品為CuCO3和Cu(OH)2的混合物,依據生成的二氧化碳物質的量計算減少碳酸銅質量,根據樣品質量計算得到氫氧化銅的質量分數=$\frac{100g-\frac{22g}{44g/mol}×124g/mol}{100g}$×100%=38%,若不進行步驟C,生成的二氧化碳氣體中含有水蒸氣,被裝置D吸收后稱量得到二氧化碳質量增大,計算得到碳酸銅質量增大,氫氧化銅的質量減小,則會使測得結果質量分數偏低,
故答案為:38%;偏低.
點評 本題考查了物質組成和性質的分析判斷,實驗過程分析,沉淀生成的原理,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氫氣還原氧化銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
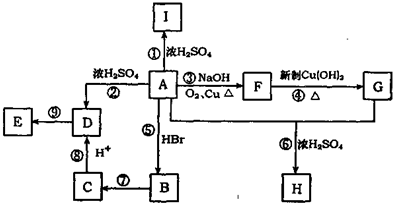
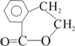 ;
; ;寫出反應⑦的化學方程式
;寫出反應⑦的化學方程式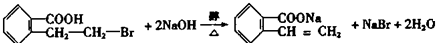 ;
;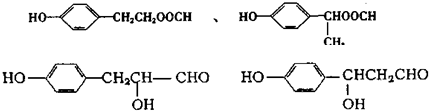
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
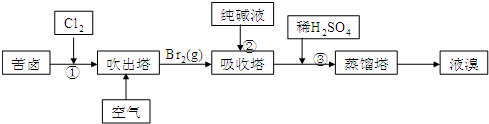
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 兩極材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀鹽酸 | H2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
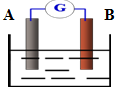 如圖為某原電池裝置:
如圖為某原電池裝置:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
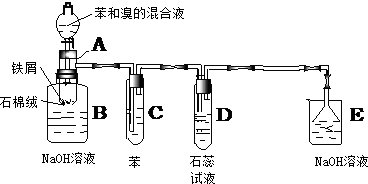

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 32gO2和32gO3的質子數均為16NA | |
| B. | 23gNa與O2在加熱條件充分反應,O2得到的電子數為2NA | |
| C. | 在標準狀況下,22.4LSO3所含分子數為NA | |
| D. | 2 L1mol•L-1的HC1溶液中,含有的HC1分子數目為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com