
分析 (1)依據熱化學方程式 和蓋斯定律計算得到;因為△H<0,△S<0,所以該反應在常壓和70~120℃條件下就能自發反應;
(2)①化學平衡常數等于平衡時生成物的濃度冪之積比上反應物濃度冪之積;
②平衡時原來變化的量,現在不變說明反應達平衡狀態;
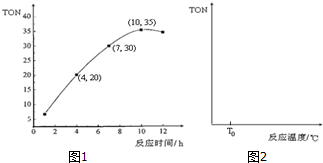
③由圖可知10h時TON的值最大,v=$\frac{△c}{△t}$計算求解;
④如果在其它條件不變的情況下,投入反應物開始,反應溫度越高反應速率越快,甲醇轉化數(TON)增大,當達到一定溫度時達平衡狀態,此時甲醇轉化數(TON)最大,然后再改變溫度平衡移動,由此分析解答;
⑤要達到平衡時下列措施能提高TON值,所以改變條件使平衡正向移動,由此分析.
解答 解:(1)ⅰCO的標準燃燒熱:-283.0kJ•mol-1,所以CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 ①,
ⅱ1mol H2O(l)完全蒸發變成H2O(g)需吸收44kJ的熱量,所以H2O(l)=H2O(g)△H=+44kJ•mol-1 ②,
ⅲ,2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g)△H=-15.5kJ•mol-1 ③;
則2CH3OH(g)+CO(g)+1/2O2(g)?CH3OCOOCH3 (g)+H2O(l)△H=①-②+③=-283.0kJ•mol-1-44kJ•mol-1-15.5kJ•mol-1=-342.5kJ•mol-1,因為△H<0,△S<0,所以該反應在常壓和70~120℃條件下就能自發反應,故答案為:-342.5kJ•mol-1;因為該反應△H<0,△S<0;
(2)①化學平衡常數等于平衡時生成物的濃度冪之積比上反應物濃度冪之積,K=$\frac{c(C{H}_{3}OCOOC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)c(C{O}_{2})}$,故答案為:K=$\frac{c(C{H}_{3}OCOOC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)c(C{O}_{2})}$;
②A.v正(CH3OH)=2v正(CO2)=2v逆(CO2),達平衡狀態,故正確;
B.平衡時CH3OCOOCH3與H2O的物質的量之比可能保持不變,也可能變化,故錯誤;
C.容器內氣體的密度始終不變,故錯誤;
D.容器內壓強不變,說明各物質的量不變,達平衡狀態,故正確;
故選:AD;
③由圖可知10h時TON的值最大,4~10h內轉化的甲醇的物質的量為6×10-5mol×(35-20)=90×10-5mol,所以轉化的DMC的物質的量為$\frac{90×1{0}^{-5}mol}{2}$=45×10-5mol,則v=$\frac{△c}{△t}$=$\frac{\frac{45×1{0}^{-5}}{0.1}}{10-4}$=7.5×10-4mol•L-1•h-1,故答案為:10;7.5×10-4mol•L-1•h-1;
④如果在其它條件不變的情況下,投入反應物開始,反應溫度越高反應速率越快,甲醇轉化數(TON)增大,當達到一定溫度時達平衡狀態,此時甲醇轉化數(TON)最大,然后再改變溫度平衡移動,正反應是放熱反應,所以升高溫度平衡逆向移動,甲醇轉化數(TON)減小,所以圖象為: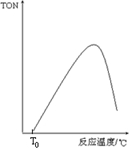 ,故答案為:
,故答案為: ;
;
⑤要達到平衡時下列措施能提高TON值,所以改變條件使平衡正向移動,
A.往反應體系中添加催化劑,平衡不移動,故不選;
B.往反應體系中添加吸水劑,生成物濃度減少,平衡正向移動,故選;
C.從反應體系中分離出CO2,減少反應物濃度平衡逆向移動,故不選;
D.擴大容器的體積,相當于減少壓強,平衡逆向移動,故不選; 故選:B.
點評 本題考查蓋斯定律、反應的自發性、化學平衡常數和平衡的移動,綜合性強,特別化學反應速率的計算有一定的難度.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一氧化碳的轉化率提高,水蒸氣的轉化率降低 | |
| B. | 反應物的轉化率都提高 | |
| C. | 平衡向正反應方向移動,達到新的平衡時二氧化碳的體積分數增大 | |
| D. | 平衡向正反應方向移動,二氧化碳的物質的量將大于1 mol但小于2 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L1mol/L的碳酸鈉溶液中含CO32-NA個 | |
| B. | 標準狀況下,11.2L甲醇與足量鈉反應,可生成標準狀況下氫氣5.6L | |
| C. | H2O2和H2O的混合物1mol中,含陰離子個數為NA | |
| D. | 標準狀況下,22.4LCl2與足量鐵充分反應,電子轉移數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 在一定條件,可逆反應:mA+nB?pC達到平衡狀態.
在一定條件,可逆反應:mA+nB?pC達到平衡狀態.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 序號 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相對強弱:HClO>HCO3- | |
| B. | 由水電離產生的c(H+):①=② | |
| C. | 溶液③④中酸根離子濃度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等體積混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com