
| 序號 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相對強弱:HClO>HCO3- | |
| B. | 由水電離產生的c(H+):①=② | |
| C. | 溶液③④中酸根離子濃度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等體積混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
分析 A、鹽的水解原理:越弱越水解,據此確定弱酸的酸性強弱;
B、能水解的鹽能促進水的電離,不水解的鹽對水的電離無影響;
C、鹽的水解原理:越弱越水解,據此根據水解程度確定溶液中離子的濃度;
D、碳酸鈉和碳酸氫鈉的混合溶液中存在物料守恒.
解答 解:A、鹽的水解原理:越弱越水解,根據數據得到NaClO中次氯酸根離子的水解程度小于Na2CO3中碳酸根離子的水解程度,所以酸性:HClO>HCO3-,故A正確;
B、醋酸銨CH3COONH4是能水解的鹽能促進水的電離,NaCl是不水解的鹽,對水的電離無影響,所以由水電離產生的c(H+):①<②,故B錯誤;
C、鹽的水解原理:越弱越水解,根據數據得到NaClO中次氯酸根離子的水解程度大于NaHCO3中碳酸根離子的水解程度,溶液③④中酸根離子濃度:c(ClO-)<c(HCO3-),故C錯誤;
D、等體積等濃度碳酸鈉和碳酸氫鈉的混合溶液中存在物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L,故D正確.
故選AD.
點評 本題考查了電解質溶液中離子濃度大小、鹽的水解原理:越弱越水解、物料守恒的理解應用,注意鹽類水解的分析應用,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 時間(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵跟鹽酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸亞鐵溶液中加過氧化氫溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 碳酸鈣跟醋酸反應:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硝酸鐵溶液中加過量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
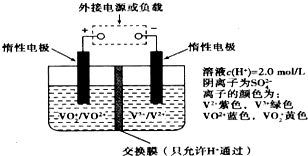 在能源和環保的壓力下,新能源電動汽車無疑將成為未來汽車的發展方向.如果電動汽車上使用新型釩電池,一次性充電3-5分鐘后,續航能力可達1000公里;而成本造價只有目前鋰電池的40%,體積和重量分別是鋰電池的$\frac{1}{25}$和$\frac{1}{10}$.全釩液流儲能電池是利用不同價態離子對的氧化還原反應來實現化學能和電能相互轉化的裝置,其原理如圖所示:下列有關該釩電池的說法不正確的是( )
在能源和環保的壓力下,新能源電動汽車無疑將成為未來汽車的發展方向.如果電動汽車上使用新型釩電池,一次性充電3-5分鐘后,續航能力可達1000公里;而成本造價只有目前鋰電池的40%,體積和重量分別是鋰電池的$\frac{1}{25}$和$\frac{1}{10}$.全釩液流儲能電池是利用不同價態離子對的氧化還原反應來實現化學能和電能相互轉化的裝置,其原理如圖所示:下列有關該釩電池的說法不正確的是( )| A. | 充電過程中,H+可以通過質子交換膜向右移動,形成電流通路,并且參與電極反應 | |
| B. | 放電過程中,右槽溶液中溶液顏色由紫色變為綠色 | |
| C. | 該電池為可逆電池,當左槽溶液逐漸由黃變藍時,為充電過程,此時左槽溶液pH值升高 | |
| D. | 充電時若轉移的電子數為3.01×1023個,左槽溶液中n(H+)增加了0.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 決定物質性質的重要因素是物質結構.請回答下列問題.
決定物質性質的重要因素是物質結構.請回答下列問題.| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 離子晶體 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,顏色變淺:2NO2(g)??N2O4(g)△H<0 (紅棕色) (無色) | |
| C. | 鐵溶于稀硝酸,溶液變黃:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液變紅:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中鹽酸電離出的c(H+)與水電離出的c(H+)之比為1010:1 | |
| B. | 向該溶液中加入等體積pH為12的氨水恰好完全中和 | |
| C. | 將10mL該溶液稀釋至100mL后,pH小于3 | |
| D. | 該溶液中由水電離出的c(H+)水×c(OH-)水=1×10-14 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com