
分析 A中僅含有O、K、Fe三種元素,在常溫和干燥的條件下化合物A可以穩定的存在,但它在水溶液中不穩定,一段時間后轉化為紅褐色沉淀,同時產生一種氣體單質,該紅褐色沉淀為Fe(OH)3;可推知A含有Fe元素.A的化合物用硫酸溶解,再加入加KOH,生成沉淀灼燒得到紅棕色固體粉末1.60g為氧化鐵,由鐵元素守恒可知,3.96g化合物A含鐵:$\frac{1.6g}{160g/mol}$×2=0.02mol,不含結晶水的鹽10.44g為硫酸鉀,3.96g化合物A中含鉀:$\frac{10.44g}{1744g/mol}$×2-0.08mol=0.04mol,3.96g化合物A中含氧:$\frac{3.96g-0.02mol×56g/mol-0.04mol×39g/mol}{16g/mol}$=0.08mol,故鉀、鐵、氧的個數比為:0.04mol:0.02mol:0.08mol=2:1:4,故A的化學式為:K2FeO4;高鐵酸鉀與水反應生成氧氣和Fe(OH)3、氫氧化鉀,反應方程式為4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,據此解答.
解答 解:中僅含有O、K、Fe三種元素,在常溫和干燥的條件下化合物A可以穩定的存在,但它在水溶液中不穩定,一段時間后轉化為紅褐色沉淀,同時產生一種氣體單質,該紅褐色沉淀為Fe(OH)3;可推知A含有Fe元素.A的化合物用硫酸溶解,再加入加KOH,生成沉淀灼燒得到紅棕色固體粉末1.60g為氧化鐵,由鐵元素守恒可知,3.96g化合物A含鐵:$\frac{1.6g}{160g/mol}$×2=0.02mol,不含結晶水的鹽10.44g為硫酸鉀,3.96g化合物A中含鉀:$\frac{10.44g}{1744g/mol}$×2-0.08mol=0.04mol,3.96g化合物A中含氧:$\frac{3.96g-0.02mol×56g/mol-0.04mol×39g/mol}{16g/mol}$=0.08mol,故鉀、鐵、氧的個數比為:0.04mol:0.02mol:0.08mol=2:1:4,故A的化學式為:K2FeO4.
(1)由上述分析可知,A的化學式為:K2FeO4;高鐵酸鉀與水反應生成氧氣和Fe(OH)3、氫氧化鉀,反應方程式為4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,
故答案為:K2FeO4;4KFeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH;
(2)化合物A可作為一種“綠色高效多功能”水處理劑,可由FeCl3和KClO在強堿性條件下反應制得,其反應的離子方程式為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl?+5H2O 或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl?+5H2O,
故答案為:2Fe3++3ClO-+10OH-=2FeO42-+3Cl?+5H2O 或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl?+5H2O;
(5)A.高鐵酸鉀在堿性條件下生成,而醋酸鈉溶液呈堿性,故A正確;
B.高鐵酸鉀在水溶液中不穩定,與酸反應,故B錯誤;
C.鐵離子與反應生成的KOH反應,使高鐵酸鉀在水溶液中更不穩定,故C錯誤;
D.高鐵酸鉀在堿性條件下生成,故D正確;
故答案為:AD.
點評 本題考查無機物推斷,屬于計算型推斷,綜合考查學生閱讀題目獲取信息的能力、計算能力、設計實驗能力等,題目難度較大,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:解答題
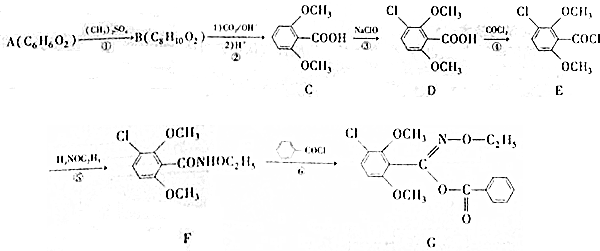
 ;⑤的反應類型為取代反應.
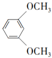
;⑤的反應類型為取代反應.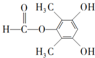 、
、 .
. 為原料制備
為原料制備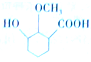 的合成路線
的合成路線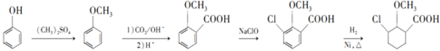
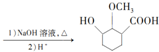
 (無機試劑可任選)
(無機試劑可任選)查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
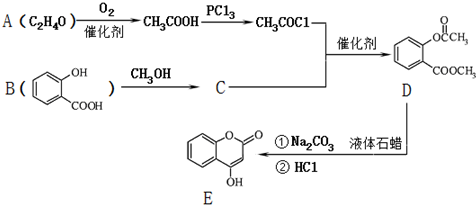
 .
. ;
;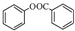 )是一種重要的有機合成中間體.試寫出以苯、甲苯為原料制取該化合物的合成路線流程圖(無機原料任選).
)是一種重要的有機合成中間體.試寫出以苯、甲苯為原料制取該化合物的合成路線流程圖(無機原料任選).查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 該物質屬于鹽類 | |
| B. | 該物質是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3mol H+ | |
| D. | 該藥劑不適合于胃潰瘍患者服用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
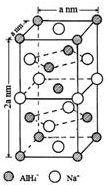 氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫.NaAlH4可由AlCl3和NaH在適當條件下合成.NaAlH4的晶胞結構如右圖所示.
氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫.NaAlH4可由AlCl3和NaH在適當條件下合成.NaAlH4的晶胞結構如右圖所示.  .
.  .
.  (標明配位鍵).
(標明配位鍵). 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 要完成實驗需稱取10.6gNa2CO3•10H2O晶體 | |
| B. | 定容后把容量瓶倒轉搖勻,發現液面低于刻度,再補充幾滴水至刻度線,會導致溶液濃度偏高 | |
| C. | 配制時若容量瓶不干燥,含有少量蒸餾水會導致濃度偏低 | |
| D. | 定容時俯視刻度線會導致濃度偏高 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 等物質的量濃度的各溶液pH關系為:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
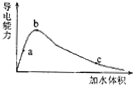
| B. | 冰醋酸中逐滴加水,則溶液的導電性、醋酸的電離程度、pH均先增大后減小 | |
| C. | 混合溶液中含有等物質的量的Na2CO3和NaHCO3,則一定存在c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | a mol/LHCN溶液與b mol/LNaOH溶液等體積混合后,所得溶液中c(Na+)>c(CN-),則b一定大于a |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com