
 ;⑤的反應類型為取代反應.
;⑤的反應類型為取代反應.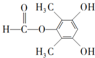 、
、 .
. 為原料制備
為原料制備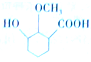 的合成路線
的合成路線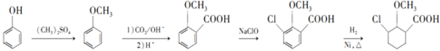
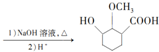
 (無機試劑可任選)
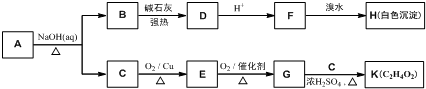
(無機試劑可任選) 分析 (1)(2)比較B的分子式和C的結構簡式可知,B為 ,根據A的分子式及A轉化成B的條件可知,A為
,根據A的分子式及A轉化成B的條件可知,A為 ,A發生取代反應生成 B,比較E和F的結構簡式可知⑤的反應類型;
,A發生取代反應生成 B,比較E和F的結構簡式可知⑤的反應類型;
(3)根據條件Ⅰ.能發生銀鏡反應也能與FeCl3溶液發生顯色反應,說明有醛基和酚羥基,Ⅱ.核磁共振氫譜有4組峰且峰面積之比為6:2:1:1,結合C的結構簡式可知C的同分異構體的種類;其中能發生水解反應的,說明有酯基,據此書寫其結構簡式;
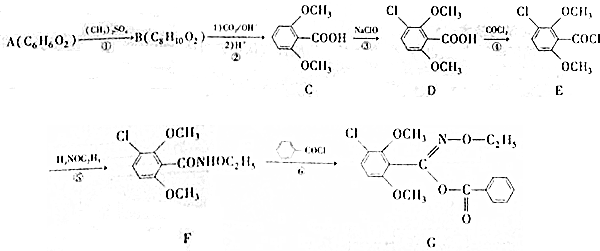
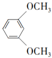
(4)依據西斗星的合成路線,以 為原料制備
為原料制備 可以將
可以將 與硫酸甲酯反應生成甲苯醚,再發生類似西斗星的合成路線中的②和③反應,再與氫氣加成后堿性水解、酸化可得
與硫酸甲酯反應生成甲苯醚,再發生類似西斗星的合成路線中的②和③反應,再與氫氣加成后堿性水解、酸化可得 ,據此答題;
,據此答題;
解答 解:(1)根據A的分子式及A轉化成B的條件可知,A為 ,A的名稱為間苯二酚或1,3-苯二酚,根據C的結構簡式可知,C中含氧官能團為羧基和醚鍵,
,A的名稱為間苯二酚或1,3-苯二酚,根據C的結構簡式可知,C中含氧官能團為羧基和醚鍵,
故答案為:間苯二酚或1,3-苯二酚;羧基和醚鍵;
(2)比較B的分子式和C的結構簡式可知,B為 ,比較E和F的結構簡式可知⑤的反應類型為取代反應,
,比較E和F的結構簡式可知⑤的反應類型為取代反應,
故答案為: ;取代反應;
;取代反應;
(3)根據條件Ⅰ.能發生銀鏡反應也能與FeCl3溶液發生顯色反應,說明有醛基和酚羥基,Ⅱ.核磁共振氫譜有4組峰且峰面積之比為6:2:1:1,結合C的結構簡式可知符合條件的同分異構體為 、
、 、
、 、
、 、
、 、
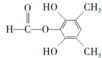
、 ,共6種,其中能發生水解反應的,說明有酯基,其結構簡式為
,共6種,其中能發生水解反應的,說明有酯基,其結構簡式為 、
、 ,
,
故答案為:6; 、
、 ;
;
;
(4)依據西斗星的合成路線,以 為原料制備
為原料制備 可以將
可以將 與硫酸甲酯反應生成甲苯醚,再發生類似西斗星的合成路線中的②和③反應,再與氫氣加成后堿性水解、酸化可得
與硫酸甲酯反應生成甲苯醚,再發生類似西斗星的合成路線中的②和③反應,再與氫氣加成后堿性水解、酸化可得 ,其合成路線為
,其合成路線為
 ,
,
故答案為:
 .
.
點評 本題考查有機物的推斷與合成,成分利用轉化關系中有機物的進行進行分析解答,較好的考查學生的分析推理能力、獲取信息能力、知識遷移運用能力,難度中等.


科目:高中化學 來源: 題型:解答題

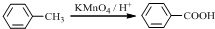
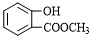 .
.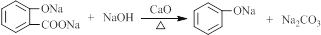 .
.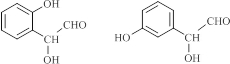 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
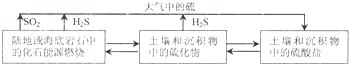
| 25℃ | 飽和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(開始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
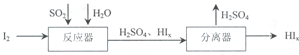
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L空氣中O2、N2分子數為NA | |
| B. | 0.1mol羥基中所含電子數目為NA | |
| C. | 鈉與氧氣反應時,每消耗4.6g鈉時生成的陰離子數目為0.1NA | |
| D. | 25℃時,1.0L pH=13的Ba(OH)2溶液中含有的OH-數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應 | 大氣固氮N2(g)+O2(g)?2NO(g) | |
| 溫度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
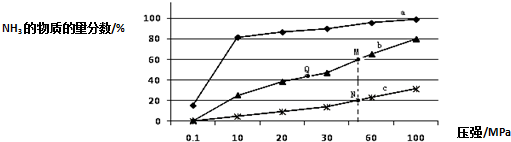
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3溶液顯弱酸性 | |
| B. | 該溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀釋該溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向該溶液中加入足量的氫氧化鈣溶液的離子方程式為:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
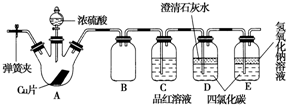
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com