
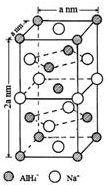
 氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫.NaAlH4可由AlCl3和NaH在適當條件下合成.NaAlH4的晶胞結構如右圖所示.
氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫.NaAlH4可由AlCl3和NaH在適當條件下合成.NaAlH4的晶胞結構如右圖所示.  .
.  .
.  (標明配位鍵).
(標明配位鍵). 分析 (1)Ti原子核外電子數為22,價電子排布式為3d24s2,結合泡利原理、洪特規則畫出價電子排布圖;
(2)NaH的熔點為800℃,不溶于有機溶劑,應屬于離子晶體,由鈉離子與氫負離子構成;
(3)氯化鋁在178℃時升華,熔沸點較低,屬于分子晶體,蒸氣的相對分子質量約為267,蒸氣分子的分子式為Al2Cl6,鋁原子最外層電子只有3個電子,形成3個共價鍵,每個鋁原子和四個氯原子形成共價鍵,且其中一個共用電子對是氯原子提供形成的配位鍵;
(4)AlH4-中,Al的軌道雜化數目為4+$\frac{3+1-1×4}{2}$=4,Al采取sp3雜化,為正四面體構型;
(5)以體心的AlH4-研究,與之緊鄰且等距的Na+位于晶胞棱之間、晶胞中上面立方體左右側面面心、晶胞中下面立方體前后面的面心,與AlH4-緊鄰且等距的Na+有8個,根據均攤法可知,晶胞中AlH4-數目為1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+數目為6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,則二者配位數相等;
結合晶胞中AlH4-、Na+數目,表示出晶胞質量,再根據ρ=$\frac{m}{V}$計算密度;
若NaAlH4晶胞底心處的Na+被Li+取代,可知晶胞中Li+為1,再計算Na+數目,而晶胞中AlH4-數目不變,可得化學式;
(6)NaAlH4的釋氫機理為:每3個AlH4-中,有2個分別釋放出3個H原子和1個Al原子,同時與該Al原子最近鄰的Na原子轉移到被釋放的Al原子留下的空位,根據原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2↑.
解答 解:(1)Ti原子核外電子數為22,價電子排布式為3d24s2,價電子排布圖為 ,
,
故答案為: ;
;
(2)NaH的熔點為800℃,不溶于有機溶劑,應屬于離子晶體,由鈉離子與氫負離子構成,電子式為 ,
,
故答案為:離子; ;
;
(3)氯化鋁在178℃時升華,熔沸點較低,屬于分子晶體,蒸氣的相對分子質量約為267,蒸氣分子的分子式為Al2Cl6,鋁原子最外層電子只有3個電子,形成3個共價鍵,每個鋁原子和四個氯原子形成共價鍵,且其中一個共用電子對是氯原子提供形成的配位鍵,結構式如圖 ,
,
故答案為: ;
;
(4)AlH4-中Al的軌道雜化數目為4+$\frac{3+1-1×4}{2}$=4,Al采取sp3雜化,為正四面體構型,與AlH4-空間構型相同的兩種離子為NH4+、SO42-等,
故答案為:sp3雜化;NH4+、SO42-等;
(5)根據均攤法可知,晶胞中AlH4-數目為1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+數目為6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,則二者配位數為1:1,以體心的AlH4-研究,與之緊鄰且等距的Na+位于晶胞棱之間、晶胞中上面立方體左右側面面心、晶胞中下面立方體前后面的面心,與AlH4-緊鄰且等距的Na+有8個,則與Na+緊鄰且等距的AlH4-有8個;
晶胞質量為4×$\frac{54}{{N}_{A}}$g,晶胞密度為4×$\frac{54}{{N}_{A}}$g÷[(a×10-7 cm)2×2a×10-7 cm]=$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$g•cm-3,
若NaAlH4晶胞底心處的Na+被Li+取代,可知晶胞中Li+為1,Na+數目為3,而晶胞中AlH4-數目不變,可得化學式Na3Li[AlH4]4,
故答案為:8;$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$;Na3Li[AlH4]4;
(6)NaAlH4的釋氫機理為:每3個AlH4-中,有2個分別釋放出3個H原子和1個Al原子,同時與該Al原子最近鄰的Na原子轉移到被釋放的Al原子留下的空位,根據原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2,反應方程式為:3NaAlH4=Na3AlH6+2Al+3H2↑,
故答案為:3NaAlH4=Na3AlH6+2Al+3H2↑.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、晶體類型與性質、雜化方式與空間構型、晶胞結構與計算等,題目素材中學基本不接觸,容易是學生產生畏懼感,側重考查學生對知識的遷移由于,(6)中注意利用原子守恒進行晶胞,避免考慮結構問題.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3溶液顯弱酸性 | |
| B. | 該溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀釋該溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向該溶液中加入足量的氫氧化鈣溶液的離子方程式為:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 按系統命名法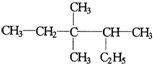 的名稱為3,3-二甲基-2-乙基戊烷 的名稱為3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是較活潑的有機物,能發生氧化反應,甲烷和苯性質較穩定,不能發生氧化反應 | |
| C. | 分子式為C5H12O的醇共有8種,其中能催化氧化成醛的同分異構體有4種 | |
| D. | A、B兩種有機化合物,無論以何種比例混合,只要混合物的總質量不變,完全燃燒后,產生水的質量也不變,則A、B滿足的條件必須是最簡式相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
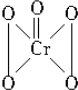
| A. | 全部-1價 | B. | $\frac{4}{5}$為-1價,$\frac{1}{5}$為-2價 | ||
| C. | 全部-2價 | D. | $\frac{4}{5}$為-2價,$\frac{1}{5}$為-1價 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 序號 | 溫度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 達到相同程度所用的時間/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用明礬和漂白粉處理自來水,二者的作用原理相同 | |
| B. | 室溫下向10mL pH=3的醋酸溶液中加水稀釋后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不變 | |
| C. | 氯水、氨水、王水是混合物,水銀、水玻璃是純凈物 | |
| D. | 可用澄清的石灰水鑒別碳酸鈉和碳酸氫鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為防止被氧化,FeSO4溶液存放在加有少量鐵粉的試劑瓶中 | |
| B. | 將金屬Li放于石蠟中密封保存 | |
| C. | 將NaOH溶液存放于磨口玻璃塞的試劑瓶 | |
| D. | 硝酸應裝在棕色瓶中密封避光保存 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com