
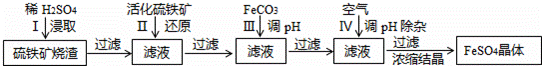
分析 硫鐵礦燒渣用硫酸浸取,過濾后濾液中含有硫酸鐵、未反應的硫酸,用活化硫鐵礦還原Fe3+后過濾,向濾液中加入FeCO3調節溶液pH,過濾后在通入空氣、調節溶液pH,除去溶液中雜質離子,過濾濃縮結晶得到FeSO4晶體.
(1)H2SO4與Fe2O3反應生成硫酸鐵與水;
(2)用KSCN 溶液檢驗第Ⅱ步中Fe3+是否完全還原;
(3)氧氣可以講亞鐵離子氧化為鐵離子,鐵離子水解使溶液pH降低;
(4)發生反應:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根據蓋斯定律,由已知熱化學方程式乘以適當的系數進行加減,構造目標熱化學方程式;
(5)電池放電時的總反應為:4Li+FeS2═Fe+2Li2S,正極發生還原反應,FeS2獲得電子生成Fe、S2-;
(6)第Ⅲ步應加入FeCO3后,浸取時加入的硫酸、活化硫鐵礦還原Fe3+時生成的硫酸完全轉化為FeSO4,根據FeS2~7Fe2(S04)3~7Fe2O3計算參加反應的FeS2的物質的量,根據硫元素守恒計算n總(FeSO4),由Fe元素守恒計算n(FeCO3),再根據m=nM計算其質量.
解答 解:硫鐵礦燒渣用硫酸浸取,過濾后濾液中含有硫酸鐵、未反應的硫酸,用活化硫鐵礦還原Fe3+后過濾,向濾液中加入FeCO3調節溶液pH,過濾后在通入空氣、調節溶液pH,除去溶液中雜質離子,過濾濃縮結晶得到FeSO4晶體.
(1)H2SO4與Fe2O3反應生成硫酸鐵與水,反應離子方程式為:Fe2O3+6H+=2Fe3++3H2O,
故答案為:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以檢驗有Fe2+生成,取第Ⅱ步反應中溶液少許與試管中,滴加KSCN 溶液,若溶液不變紅色,說明Fe3+完全被還原,
故答案為:C;
(3)氧氣可以將Fe2+離子氧化為Fe3+離子,Fe3+離子水解生成H+,使溶液pH降低,
故答案為:氧氣可以將Fe2+離子氧化為Fe3+離子,Fe3+離子水解生成H+;
(4)發生反應:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根據蓋斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反應熱化學方程式為:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案為:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(5)電池放電時的總反應為:4Li+FeS2═Fe+2Li2S,正極發生還原反應,FeS2獲得電子生成Fe、S2-,正極電極反應式為:FeS2+4e-=Fe+2S2-,
故答案為:FeS2+4e-=Fe+2S2-;
(6)Fe2O3含量為50%,ckg燒渣中,Fe2O3質量為50%×ckg,鐵的浸取率為96%,側參加反應的Fe2O3質量為50%×ckg×96%,其物質的量為(50%×c×103×96%)g÷160g/mol=3c mol,
akg質量分數為b%的硫酸中m(H2SO4)=b%×akg,其物質的量為(b%×a×103)g÷98g/mol=$\frac{10ab}{98}$mol,
第Ⅲ步應加入FeCO3后,浸取時加入的硫酸、活化硫鐵礦還原Fe3+時生成的硫酸完全轉化為FeSO4,
根據FeS2~7Fe2(S04)3~7Fe2O3,可知參加反應的FeS2的物質的量$\frac{1}{7}$×3c mol,
根據硫元素守恒計算n總(FeSO4)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol,
由Fe元素守恒n(FeCO3)=n總(FeSO4)-n(FeS2)-2n(Fe2O3)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol-$\frac{1}{7}$×3c mol-2×3c mol=$\frac{10ab}{98}$mol-$\frac{39c}{7}$mol,故m(FeCO3)=($\frac{10ab}{98}$-$\frac{39c}{7}$) mol×116g/mol≈(11.8ab-646c)g,即為(0.0118ab-0.646c)Kg,
故答案為:(0.0118ab-0.646c).
點評 本題以化學工藝流程為載體,考查離子方程式書寫、離子檢驗、熱化學方程式書寫、電極反應式、化學計算等,需要學生熟練掌握元素化合物知識,(6)中計算為易錯點、難點,注意利用守恒法計算,避免計算繁瑣,較好的考查學生分析計算能力.


科目:高中化學 來源: 題型:解答題
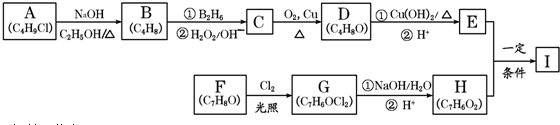
 ,該反應類型為取代反應.
,該反應類型為取代反應. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)
X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶于水只發生擴散作用 | |
| B. | 氫氧化鈉溶于水只發生水合作用 | |
| C. | 氫氧化鈉溶于水擴散過程吸收熱量大于水合過程放出的熱量 | |
| D. | 氫氧化鈉溶于水擴散過程吸收熱量小于水合過程放出的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H相同 | |
| B. | 任何酸與堿發生中和反應生成1 mol H2O的過程中,能量變化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,則△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金剛石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 則C(s,石墨)=C(s,金剛石)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備Fe(OH)3膠體:向0.1mol•L-1FeCl3溶液中加入等體積0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入適量鐵粉至藍色剛好消失后過濾 | |
| C. | 配制1mol/LMgSO4溶液:將12.0gMgSO4固體倒進100mL容量瓶中,然后加入100mL蒸餾水 | |
| D. | 確定Na2CO3溶液中是否混有NaOH:取少量溶液滴加過量BaCl2溶液,過濾取濾液,在濾液中滴加酚酞,觀察是否出現紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com