
 X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)
X、Y、Z、R是元素周期表中前四周期中的常見元素.X的單質是密度最小的氣體;Y的一種核素常用于考古,且其一種同素異形體是較軟的物質之一;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙;R2+離子的3d軌道有9個電子.(答題時用具體的元素符號)分析 X的單質是密度最小的氣體,則X為H元素;Y的一種核素常用于考古且其一種同素異形體是較軟的物質之一,則Y為C元素;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙,則Z為N元素;R2+離子的3d軌道有9個電子,原子核外電電子排布式為1s22s22p63s23p63d104s1,則R為Cu,據此解答.
解答 解:X的單質是密度最小的氣體,則X為H元素;Y的一種核素常用于考古且其一種同素異形體是較軟的物質之一,則Y為C元素;Z的氣態氫化物與其最高價氧化物的水化物相遇會產生大量白煙,則Z為N元素;R2+離子的3d軌道有9個電子,原子核外電電子排布式為1s22s22p63s23p63d104s1,則R為Cu.
(1)R2+離子的3d軌道有9個電子,原子核外電電子排布式為1s22s22p63s23p63d104s1,處于周期表中第四周期IB族,Z為N元素,基態原子價層電子排布式為2s22p3,
故答案為:第四周期IB族;2s22p3;
(2)NH3分子間形成氫鍵,比同族相鄰元素的氣態氫化物熔點高很多,
故答案為:NH3分子間形成氫鍵;
(3)H與C可形成多種化合物,其中以直線型存在的4核分子為H-C≡C-H,分子中σ鍵與π鍵之比為 3:2,
故答案為:3:2;
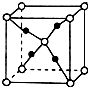
(4)Cu可以形成多種氧化物,其中一種的晶體晶胞結構如圖,晶胞中黑色球數目為4,白色球數目為1+8×$\frac{1}{8}$=2,原子數目之比為2:1,故為Cu2O,白色球為O,黑色球為Cu,氧的配位數是4,
故答案為:Cu2O;4;
(5)已知:①:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ?mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) H=-1160.0KJ/mol
根據蓋斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol,
故答案為:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,注意對基礎知識的理解掌握.


 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:選擇題
| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化劑,又是還原劑 | |
| C. | 還原劑是HCl | |
| D. | 每生成1mol Cl2轉移電子的物質的量為6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .合成N、F的路線如下:
.合成N、F的路線如下: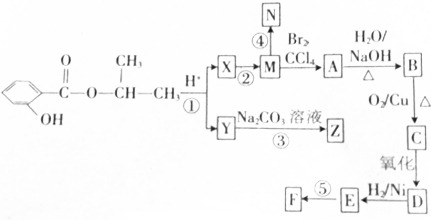
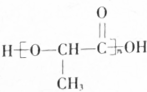
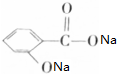 ,寫出與X具有相同官能團的一種同分異構體的名稱:1-丙醇.
,寫出與X具有相同官能團的一種同分異構體的名稱:1-丙醇. →
→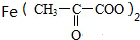 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
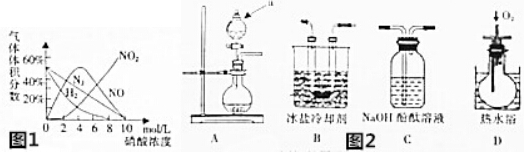
 某溫度時,在2L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示.由圖中數據分析:
某溫度時,在2L密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示.由圖中數據分析:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2L CO2與8.5g NH3所含分子數相等 | |
| B. | 等質量的H3O+和OH-質子數之比與電子數之比相同 | |
| C. | 同溫同壓下,相同體積的H2和CO2的原子數之比為2:3 | |
| D. | 同溫同壓下,相同質量的NO和C2H4(氣體)體積相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用蒸發皿蒸發溶液時,邊加熱邊用玻璃棒攪拌,直到液體全部蒸干 | |
| B. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| C. | 做焰色反應實驗所用的鉑絲應先蘸稀硫酸,再放在火焰上燒至無色 | |
| D. | 萃取操作時,應選擇有機萃取劑,且萃取劑的密度必須比水大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com